刘刚教授课题组近期在Chemical Communications(https://pubs.rsc.org/en/content/articlelanding/2021/cc/d1cc05187c)及European Journal of Medicinal Chemistry(https://doi.org/10.1016/j.ejmech.2022.114835)发表了新型结核分枝杆菌单细胞荧光诊断试剂研究结果。该项研究由李雪媛博士、耿鹏飞博士生及洪小巧博士生等完成,并得到了首都医科大学北京胸科医院孙照刚博士的支持。
结核病(Tuberculosis, TB)是由单一病原体结核分枝杆菌(Mycobacterium tuberculosis, Mtb)感染引起的致死性传染病,严重地危害了公众的健康安全。1995年,世界卫生组织(WHO)将每年3月24日定为世界防治结核病日,以提醒公众加深对结核病的认识,并设定2035年为结核终结年,全球实现结核病<10 /100,000流行的目标。
为了更好地降低TB 的发病率和死亡率,在病程早期就能够进行精准诊断尤为重要。目前,X-pert技术在结核病的诊断中得到了广泛应用,但细菌学检测仍然是最准确的方法。例如,在2020年全球被诊断出患有肺结核的患者中,59%是通过细菌学方法确诊的1。细菌学主要包括细菌培养法和痰涂片镜检法。其中,培养法结合菌种鉴定被视为TB诊断的金标准,但检测时间较长;痰涂片镜检法,检测成本低,检测速度快,更适合 TB 的快速检测。临床上常用抗酸染色法和金胺O荧光染色法进行镜检观察(主要是痰样本),但这两种方法存在由染料残渣、杂质蛋白、纤维、食物残渣等引起的假阳性结果,且无法区分活菌和死菌状态等问题。区分死活菌对于早期准确评估治疗效果则至关重要,有助于指导调整用药方案。
目前已报道了多种结核分枝杆菌新型荧光探针,由于临床痰液样本中存在不同的菌种和复杂的成分,对荧光探针的化学结构稳定性、光学稳定性、特异性以及样本处理稳定性等多方面均有较高的要求,因此,研究多停留在实验室水平,暂无成功转化的成果
刘刚教授课题组及合作伙伴首次发现天然四环双吡喃香豆素(+)-calanolide A的硝基呋喃衍生物(NFCs)对复制型和非复制型Mtb均具有很好的抑制作用2。 深入的机制研究表明,NFC类化合物进入菌内后,可被分枝杆菌中rv2466c基因编码的硝基还原酶Rv2466c识别,并在放线菌(Mtb属于放线菌目)所分泌的特有小分子硫醇mycothiol辅助下,NFC分子中的硝基基团被还原成氨基,此过程中释放的活性物质可对Mtb起到抑制作用,并伴有香豆素荧光团的荧光由淬灭到开启(off-on)的过程(图1)3, 这一现象被成功地应用于临床样本中Mtb的活力测定及药敏试验(drug susceptibility tests, DST)的高通量筛选,显著提高了药敏检测Mtb的速度和通量4。
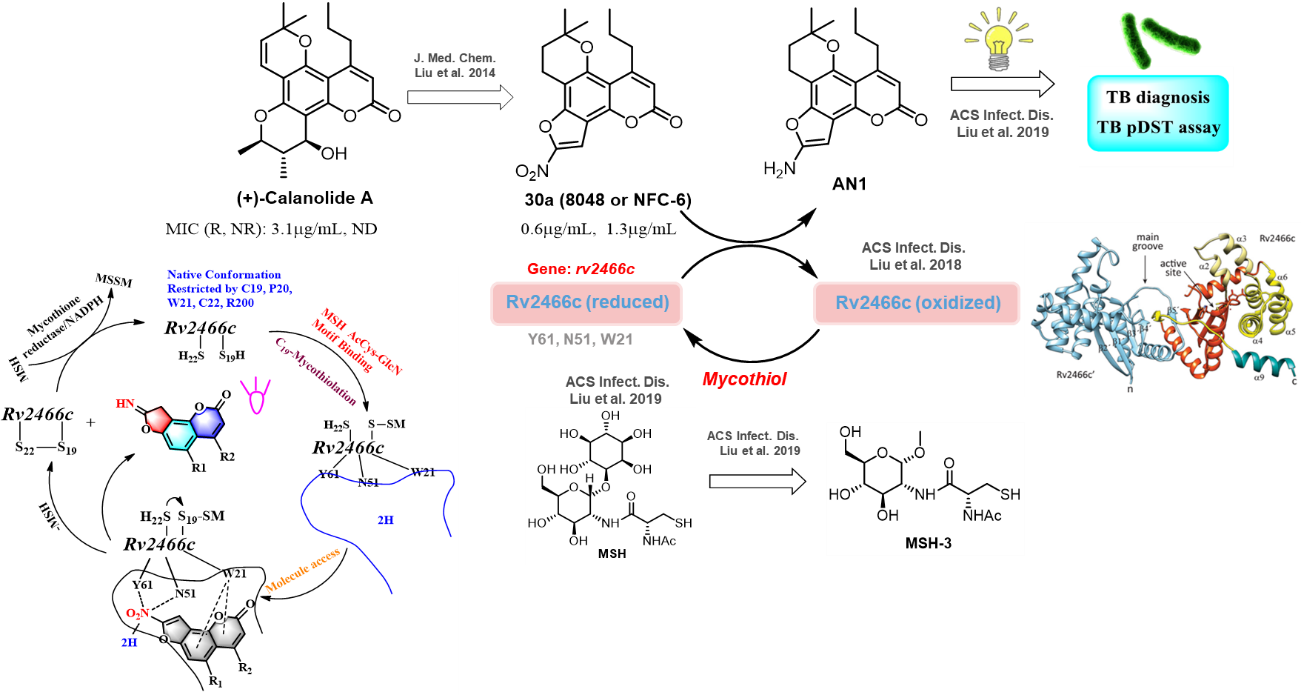
图1. 天然四环双吡喃香豆素(+)-calanolide A衍生物的抗结核分枝杆菌活性及其检测应用
在此基础上,刘刚教授课题组继续深入探索了NFC类化合物的荧光活性与结构之间的关系5,6,发现部分NFC分子可标记单细胞Mtb,并通过在NFC分子中引入分枝杆菌细胞壁所特有成分,海藻糖trehalose(Tre),开发了 2 个蓝绿波段的 NFC-Tre 类荧光探针。该类分子具有较高的标记效率,对活的Mtb具有更好的选择性,并可实现对感染宿主巨噬细胞内Mtb的标记,为研究 Mtb 与宿主细胞之间的相互作用提供了新的工具分子;同时该类分子也首次实现对多种压力模型下的非复制状态Mtb标记染色,有望应用于研究潜伏性TB;此外,在临床阳性痰液样本中,该类分子能够检测出Mtb,可作为镜检分子对TB病人痰液中的Mtb进行检测(图2)。与萋-尼抗酸染色法和金胺O法相比,在操作步骤上NFC-Tre分子无需脱色处理,操作更加简便,缩短了检测时间。最后,该类分子是一个Rv2466c酶激活型探针,仅能标记活Mtb,可真实地反映痰液中活菌的状态及数量,具有应用于评估TB病人真实病情的潜力,或者用于评估服药患者短期内治疗效果的潜力,进一步指导临床用药方案6。
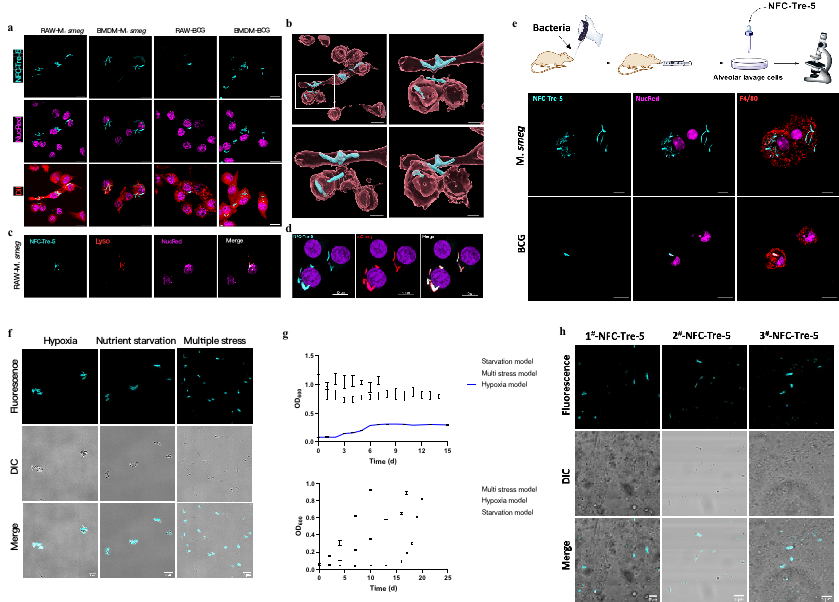
图2. NFC-Tre 类探针选择性标记宿主巨噬细胞内分枝杆菌和非复制Mtb
回顾(+)-Calanolide A分子研究的整个过程,存在几个分子变身的关键事件(图3)。(+)-Calanolide A于1992年首次被发现为HIV-1的非核苷类逆转录酶抑制剂,因其具有独特的生物学及药学的分子特征,是目前唯一一个经过临床试验研究的天然抗艾滋病候选药物,刘刚教授课题组研究该分子已有20余年。然而,作为抗艾滋病药物的候选物,无论是天然化合物(+)-calanolide A本身,还是经过优化得到的更具成药性的分子F188-11,终因合成工艺制备问题、亦或是同类分子的竞争问题而止步于进一步的临床试验及开发。
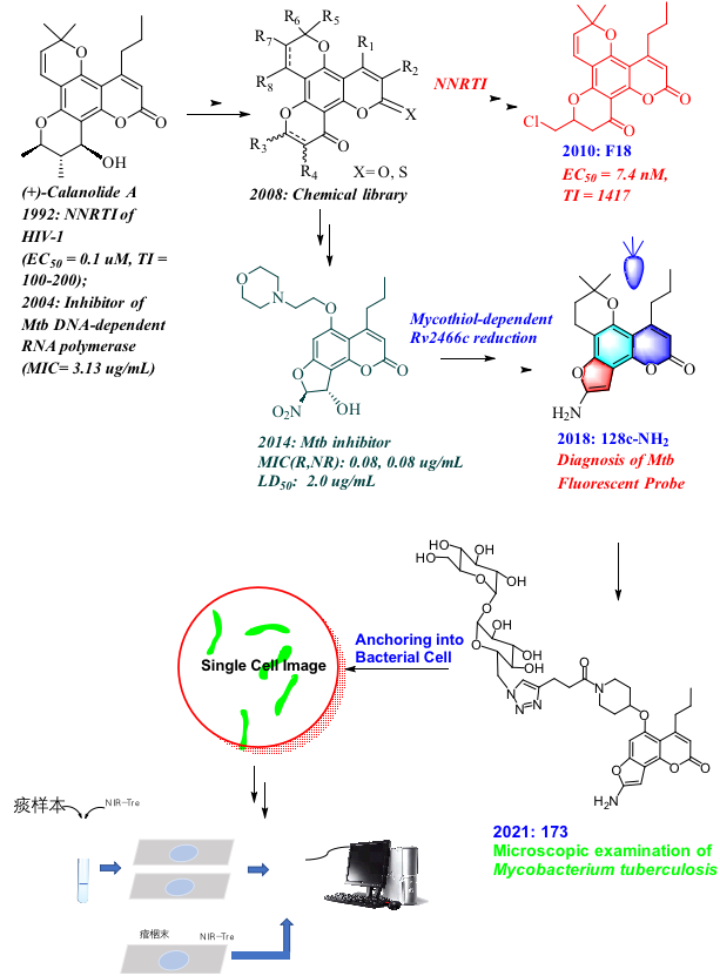
图3. (+)-Calanolide A分子功能变身的关键事件
(+)-Calanolide A于2004年再被发现具有抗Mtb的活性。在比尔-盖茨基金资助下,刘刚教授研究团队及其合作者(美国康奈尔大学医学院Carl F. Nathan教授)利用前者研究团队构建的相关化学库,瞄准发现同时抗复制型Mtb及非复制型Mtb的药物研究方向和目标,发现了具有高活性、可抑制感染宿主巨噬细胞内Mtb的NFC类分子,但止步于分子的基因毒性2。该类分子具有不同于其他抗结核药物的高活性及抑菌选择性,刘刚课题组及其合作伙伴对该类分子的作用机制进行了长达7年的研究,最终发现此类分子可在放线菌分泌的低分子量硫醇化合物mycothiol(MSH)的辅助下,被新型硝基还原酶Rv2466c还原,释放的活性氧产生了杀菌作用,并基本证明了三元复合分子RvMN(Rv2466c-MSH-NFC)间的相互作用方式。刘刚教授研究团队随后意识到,NFC类分子具有荧光探针香豆素的基本分子骨架特征,具有荧光被细菌“off-on”的可能性,并开发出了前文描述、可用于结核病药敏实验的新型荧光诊断试剂、以及Mtb单细胞荧光诊断试剂。
值得强调的是,刘刚教授课题组观察到了有些能够在体外被Rv2466c还原的NFC抑菌分子,可以在菌外培养液中测到还原荧光分子,进而开发出新的药敏实验方法;但有些NFC分子的还原产物(荧光分子)却可能被“锚定”滞留在菌内,并进而开发了Mtb新型单细胞荧光诊断试剂。这一单细胞诊断技术具有很广泛的潜在应用前景,不仅可以提高临床菌学镜检技术的灵敏性,也能简化临床菌学镜检诊断的操作步骤,减少检验员的暴露机会;而且可能为研究宿主细胞与Mtb的相互作用、建立新的基于宿主细胞的诊断技术、发现新的药物靶标、开发新的抗结核药物打下了基础。
参考文献:
1. World Health Organization. (2021) Global Tuberculosis Report, https://www.who.int/publications/i/item/9789240037021.
2. ZHENG P R, et al. Synthetic calanolides with bactericidal activity against replicating and non-replicating Mycobacterium Tuberculosis. J. Med. Chem., 2014, 57(9): 3755-72.
3. NEGRI A, et al. Identification of a mycothiol-dependent nitro-oxidoreductase from Mycobacterium Tuberculosis. ACS Infect. Dis., 2018, 4(5): 771-87.
4. MU R, et al. Nitrooxidoreductase Rv2466c-dependent fluorescent probe for Mycobacterium Tuberculosis diagnosis and drug susceptibility testing. ACS Infect. Dis., 2019, 5(6): 949-61.
5. LI X Y, et al., Detecting Mycobacterium Tuberculosis using a nitrofuranyl calanolide–trehalose probe based on nitroreductase Rv2466c, Chem Commun (Camb). 2021, 57, 13174-13177.
6. GENG P F, et al, Optimization of nitrofuranyl calanolides for the fluorescent detection of, E. J. Med. Chem.244(2022) 114835.
7. MA T, et al. Chemical resolution of (±)-calanolide A, (±)-cordatolide A and their 11-demethyl analogues. Bioorg. Med. Chem. Lett., 2008, 18(3): 1079-83.
8. MA T, et al. Chemical library and structure-activity relationships of 11-demethyl-12-oxo calanolide A analogues as anti-HIV-1 agents. J. Med. Chem., 2008, 51(5): 1432-46.
9. XUE H, et al. Highly suppressing wild-type HIV-1 and Y181C mutant HIV-1 strains by 10-chloromethyl-11-demethyl-12-oxo calanolide A with druggable profile. J. Med. Chem., 2010, 53(3): 1397-401.
10. LU X F, et al. F18, a novel small-molecule NNRTI, inhibits HIV-1 replication using distinct binding motifs as demonstrated by resistance selection and docking analysis[J]. Antimicrob. Agents Chemother., 2011, 56(1): 341-51.
11. ZHANG L L, et al. HPLC enantio-separation, absolute configuration determination and anti-HIV-1 activity of (±)-F18 enantiomers. Yao Xue Xue Bao, 2015, 50(6): 733-7.
原文链接:
Chemical Communications:https://pubs.rsc.org/en/content/articlelanding/2021/cc/d1cc05187c
European Journal of Medicinal Chemistry:https://doi.org/10.1016/j.ejmech.2022.114835


