2022年1月1日,白菜网注册领取体验钱锋课题组在药物递送领域的知名期刊《Theranostics》在线发表题为《利用巨胞饮针对KRAS突变的肿瘤进行药物递送》(Exploiting macropinocytosis for drug delivery into KRAS mutant cancer)的综述论文。KRAS 突变是最常见肿瘤相关基因突变之一,尤其高发于胰腺癌、肺癌和结直肠癌。长期以来,KRAS 突变一直被认为是不可成药的靶点,除了针对G12C突变亚型的抑制剂成功开发外,直接靶向 KRAS 突变的进展仍然有限。科学家们尝试利用KRAS 突变细胞异常的代谢行为进行选择性的药物递送。巨胞饮作用是一种非选择性的内吞途径,在 KRAS 突变的肿瘤细胞中上调,并对细胞的营养获取和存活增殖起着关键作用。研究者们观察到多种药物递送系统可以被KRAS 突变的癌细胞通过巨胞饮作用内吞,利用巨胞饮作用将治疗药物递送至 KRAS 突变肿瘤细胞正在成为一种新的药物递送探索。论文回顾了KRAS 突变诱导的巨胞饮作用的肿瘤生物学研究,总结了最近利用增强的巨胞饮对 KRAS 突变癌细胞进行选择性药物递送的研究,并讨论了这种递送策略用于抗肿瘤治疗的潜在机遇和挑战。
巨胞饮
对细胞外物质的主动转运是活细胞的基本活动之一,是完成信号转导、营养吸收、抗原摄取等许多重要生物学功能所必需的。主要的内吞途径包括巨胞饮作用(Macropinocytosis)、网格蛋白介导的内吞作用、小窝介导的内吞作用和网格蛋白/小窝非依赖的内吞作用,不同途径具有不同的调节机制。其中,巨胞饮作用是细胞从外部环境中摄取液体和溶质的一种内吞途径,它被认为是不依赖受体、依赖肌动蛋白的非选择性内吞途径。早在 1931 年,Warren Lewis 就从形态学上描述了这一过程:在生长因子刺激下,大鼠巨噬细胞中观察到质膜的波浪状片状延伸,并演变成直径大于 0.2 μm 的囊泡,Lewis 将这种活动命名为胞饮作用(后来更名为巨胞饮作用),在该途径中产生的囊泡称为巨胞饮体。巨胞饮作用对Na⁺/H⁺ exchangers (NHE) 抑制剂敏感,其原理是在 NHE 被抑制后,H⁺ 滞留在细胞内,导致细胞溶质 pH 值降低,继而影响巨胞饮过程的关键蛋白Rac1 和 Cdc42 向质膜的募集和激活。因此,NHE 抑制剂阿米洛利及其类似物 5-(乙基-N-异丙基)阿米洛利 (EIPA) 作为巨胞饮作用的特异性抑制剂广泛用于鉴别巨胞饮作用。
KRAS突变诱导的巨胞饮
巨胞饮作用的特征之一是它可以受到生长因子(包括 EGF)的刺激。RAS 位于 EGFR 信号通路的下游,可以被生长因子刺激或致癌突变激活,从而刺激巨胞饮作用所必需的信号转导通路,包括 Rac1、Cdc42 等。哺乳动物细胞中存在三种RAS 亚型:HRAS、KRAS 和 NRAS。Bar-Sagi 和 Feramisco 早在 1986 年就报道了致癌 HRAS 蛋白诱导的巨胞饮作用。KRAS突变的不同亚型与巨胞饮作用的关系均有研究, G12C、G12D、G12V亚型在不同的研究中显示出诱导巨胞饮作用的能力,但 G12R 除外。NRAS 相关巨胞饮的研究则未见报道。
巨胞饮作用是一种普遍的细胞过程,在 KRAS 突变的肿瘤细胞和正常细胞中都存在。因此,定量分析 KRAS 突变的肿瘤细胞和 KRAS 野生型的正常细胞的巨胞饮作用水平有助于理解这种“增强的巨胞饮作用”在多大程度上可以被用来提高药物递送的选择性。迄今为止,大多数文献报道了采用Commisso 等人报道的方法检测巨胞饮水平,即将细胞或组织样品在含有 1-2 mg/mL 荧光标记葡聚糖(一种巨胞饮的底物)的无血清培养基中培养 30 分钟,然后使用荧光显微镜统计细胞中的平均荧光点数。尽管 KRAS 突变的肿瘤细胞巨胞饮作用升高已被不同实验室反复验证,但各项研究报道的巨胞饮水平绝对数值差异很大,目前对于KRAS 突变增强巨胞饮作用的程度仍难以定论。
利用KRAS突变诱导的巨胞饮进行药物递送
KRAS突变肿瘤细胞增强的巨胞饮这一生物学现象提示了一种潜在的药物递送策略:假设某个药物递送系统可以通过巨胞饮作用更多的被肿瘤细胞摄取,而更少的被正常细胞摄取,那么意味着这个药物递送系统可能存在一定的KRAS突变细胞选择性,有望提高荷载药物在KRAS突变细胞中的递送效率。
白蛋白相关的药物系统是研究最多的巨胞饮底物之一。人血清白蛋白(HSA)是人体内含量最丰富的血清蛋白, KRAS突变的胰腺癌细胞可以通过巨胞饮作用摄取胞外白蛋白并将其降解为氨基酸,作为重要的营养来源。有研究表明,将小分子药物阿霉素与天然白蛋白共价偶联,可以模拟白蛋白的内吞和细胞内转运过程,从而利用增强的巨胞饮作用扩大细胞毒性药物在KRAS 突变胰腺癌肿瘤模型中的治疗窗口。Abraxane™是白蛋白结合型紫杉醇(nab-PTX),目前与吉西他滨联合用作晚期胰腺癌的一线治疗。有研究在肺癌的转基因肿瘤模型中,通过EIPA 抑制实验和 nab-PTX 与荧光葡聚糖的亚细胞共定位实验验证了KRASG12D 的肿瘤细胞对 nab-PTX 的巨胞饮摄取;该研究还发现,在KRAS野生型的肿瘤细胞中的诱导瞬时的 KRASG12D 过表达增强了 nab-PTX 的摄取。除了小分子外,白蛋白也被用于递送蛋白质/肽类药物,多项研究报道了白蛋白与治疗性蛋白/肽的融合蛋白也可以通过巨胞饮的方式进入KRAS突变的肿瘤细胞。除了白蛋白相关的药物递送系统外,研究者们还报道了不同的药物递送载体,可以被 KRAS 突变的肿瘤细胞通过巨胞饮作用内吞,包括脂质、高分子聚合物、外泌体和无机纳米颗粒等,如图1。
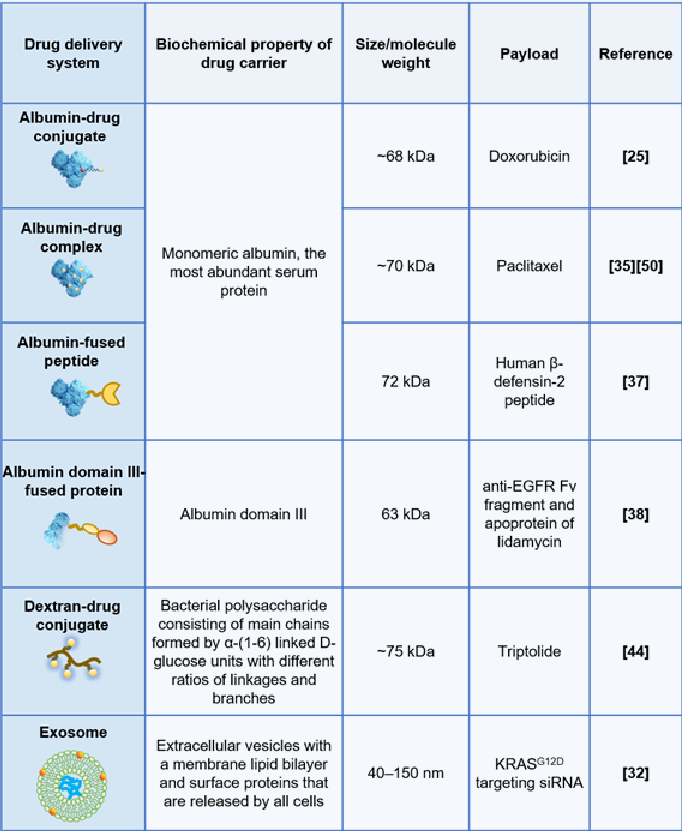
图1 通过巨胞饮机制被KRAS突变细胞内吞的药物递送系统
多项独立研究表明,KRAS 突变的肿瘤细胞具有增强的巨胞饮作用,这些细胞通过巨胞饮作用内吞胞外蛋白质并将其降解为氨基酸,为肿瘤细胞的生物合成提供营养来源。除了胞外蛋白,许多药物递送载体也可以通过巨胞饮作用进入 KRAS 突变的肿瘤细胞,这些发现鼓励研究者们尝试利用巨胞饮作用将药物选择性地输送到KRAS 突变的肿瘤细胞中。要将这种药物递送策略往临床应用推进,仍然面临一些未知和挑战:①人们对巨胞饮过程在分子层面的认识仍然有限。目前用于鉴定一个药物递送载体是否通过巨胞饮机制内吞,仅有的手段是使用EIPA抑制剂,这种方法的特异性和准确性不足。因此,非常需要开发高度特异的化学和遗传干扰工具用于识别巨胞饮作用;而这依赖于巨胞饮过程在分子层面的研究。②缺乏实时、定量的体内巨胞饮水平检测方法。肿瘤患者是高度异质性的,并非所有患者都能受益于这种药物递送策略,如何准确方便的检测每位患者肿瘤细胞的巨胞饮水平可能是转化医学研究的需要解决的技术障碍。③除了KRAS突变的肿瘤细胞外,一些特殊的细胞类型如巨噬细胞和树突状细胞,也存在活跃的巨胞饮,这表明基于巨胞饮的药物递送策略可能存在脱靶效应风险。思考这些挑战,并通过精心设计的研究寻求解决方案将真正帮助我们了解巨胞饮,从而指导药物递送系统的合理设计,为这种药物递送策略未来的临床应用铺平道路。


