2022年1月1日,白菜网注册领取体验钱锋课题组在药物递送领域的知名期刊 《Theranostics》在线发表题为“巨胞饮葡聚糖协助药物在KRAS突变胰腺癌中的靶向递送”(Macropinocytic dextran facilitates KRAS-targeted delivery while reducing drug-induced tumor immunity depletion in pancreatic cancer)的科研论文。胰腺癌内部复杂的微环境中包含了肿瘤细胞和非肿瘤细胞等多种组分,设计合适的递送系统,选择性地将细胞毒性药物传递给癌细胞,并限制其对肿瘤微环境中的抑癌良性细胞,如效应淋巴细胞的附带损伤,具有重要的价值。胰腺癌细胞具有致癌基因KRAS突变,可诱导细胞产生高水平的巨胞饮。受到癌细胞这种异常行为的启发,作者试图探索葡聚糖(Dextran,一种被认为以巨胞饮依赖的方式内吞的生物材料)的靶向潜力。首先研究了不同分子量葡聚糖的入胞偏好、机制和亚细胞分选。然后将雷公藤甲素(一种有效的细胞毒素Triptolide)作为葡聚糖偶联的模型药物分子。通过体外细胞研究和体内肿瘤模型评估,研究了葡聚糖偶联TP对KRAS基因的选择性和胰腺癌的治疗效果。
70kDa的葡聚糖具有更好靶向KRAS的潜力
在体外细胞实验中,作者测定了巨胞饮抑制剂EIPA作用前后,4kDa, 70kDa, 150kDa等不同分子量的葡聚糖在两个KRAS突变细胞(MIAPaCa-2和Panc-1)和两个KRAS野生型细胞(BxPC-3和NIH3T3)的入胞效率。发现70kDa的葡聚糖在所有的测试细胞系中都表现出普遍的EIPA敏感性和巨胞饮的内吞依赖性。相比之下,虽然4kDa和150kDa的葡聚糖可以通过大胞饮作用内化到一些细胞中(4kDa的葡聚糖进入BxPC-3细胞(图1A),150kDa的葡聚糖进入NIH3T3细胞(图1C)),但它们与70kDa葡聚糖的依赖水平不同。
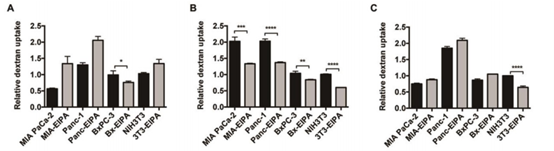
图1 70kDa的Dextran具有更显著的KRAS靶向性 (A: 4kDa Dextran, B:70kDa Dextran, C: 150kDa Dextran)
作者通过酯键的方式将小分子药物TP与70kDa的Dextran进行了偶联(图2 A和B),通过比较TP和DEX-TP对BxPC-3和BxPC-3 KRASG12V细胞的疗效,发现DEX-TP对KRAS突变表现出更强的药物疗效(图2C),而TP没有选择性(图2D)。
由于内吞转运的动力学,葡聚糖的偶联导致了药物效价的降低,即药物半抑制浓度的增加。作者设定了新的公式以定量评估DEX-TP内吞转运的效率,更高的内吞转运的效率值表明更显著的内吞转运过程。在实验中,KRAS突变型细胞与KRAS野生型细胞之间的DEX-TP细胞沉积效率存在高达3-10倍的明显差距。对于KRAS突变型癌细胞,其DEX-TP沉积效率在5.9到7.3之间;然而,对于KRAS野生型细胞,这些值的范围为0.2到2(图2E)。
作者进一步研究了KRAS对DEX-TP体内疗效的影响。建立来自MIAPaCa-2、BxPC-3和BxPC-3 KRASG12V细胞的皮下异种移植模型,平行比较了DEX-TP和TP的抗肿瘤作用。在这些比较中,作者观察到只有在KRAS突变的细胞来源的异种移植模型中,即MIAPaCa-2-(图2F)和BxPC-3 KRASG12V(图2H)的模型中,DEX-TP的肿瘤生长抑制率高于游离TP。然而,与之形成鲜明对比的是,在BxPC-3 的异种移植模型中并不存在这种差异,作者观察到DEX-TP并没有改善TP的治疗效果(图2G)。然而,一旦重新引入致癌的KRASG12V,治疗差异再次出现(图2H)。
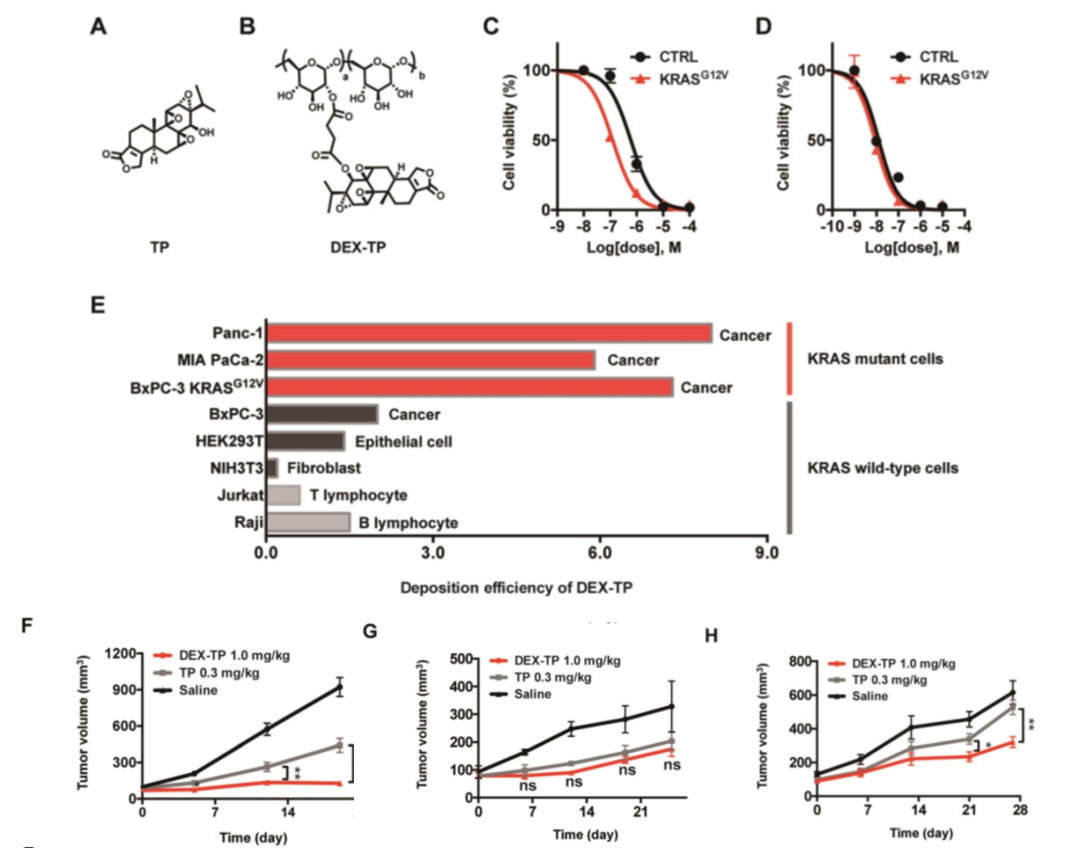
图2 DEX-TP增强了对KRAS突变胰腺癌细胞的毒性和对肿瘤生长的抑制能力
利用荧光素酶表达原位的MIAPaCa-2作者构建了原位的胰腺癌模型,用以进一步评估DEX-TP的治疗效果,记录肿瘤生长(生物发光监测)和小鼠生存情况,同时比较dex-TP、游离TP和PDAC一线化疗药物GEM等治疗方法(图3A)。
基于荧光图像,给药量0.3mg/kg和1.0mg/kg 的DEX-TP在整个实验过程中都显著抑制了肿瘤生长(图3B和4C)。在第22天治疗结束时,1.0mg/kg DEX-TP显示出优于GEM的抗肿瘤优势(图3D)。而且在治疗期间,没有观察到DEX-TP治疗的安全性问题或体重下降。与之相对比,GEM和TP治疗组,每一组均发生了与药物相关的小鼠死亡。
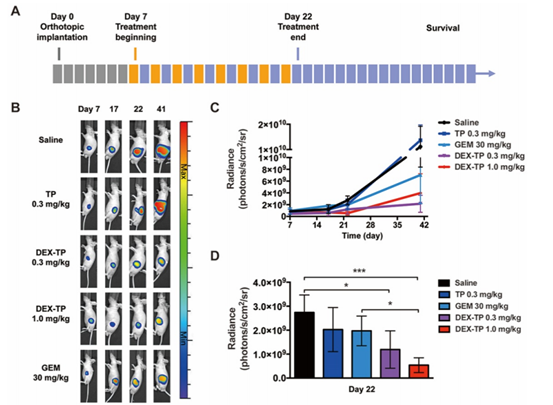
图3 DEX-TP增抑制了胰腺原位MIAPaCa-2肿瘤的生长
作为药物分子,雷公藤甲素的不良作用之一是对白细胞的抑制作用,TP作为一种免疫抑制因子,已在中药中应用于自身免疫性疾病的治疗数百年。然而,癌症治疗正倾向于利用免疫系统来对抗肿瘤的进展。由于葡聚糖被证明可以提高TP的癌细胞选择性,作者想知道这些偶联物是否会以一种更有利于免疫系统的方式表现出来。在实验中作者采用免疫活性KPC异体移植小鼠模型来研究DEX-TP对肿瘤微环境的影响(图4A)。KPC同种异体移植瘤具有一些临床相关的病理特性,如明显纤维化和多成分组成。葡聚糖偶联药物组治疗后的总生存率高于游离药物治疗(图4B)。
此外,两种治疗对肿瘤免疫反应有很大的不同,这从免疫细胞标志物CD8、CD4、CD3和CD45等抗肿瘤效应细胞因子IFN-γ和TNF-α等抗肿瘤效应因子的表达水平升高可以看出。对于游离TP,观察到明显的免疫抑制表型,而对于DEX-TP,这种损伤明显被逆转(图4 C和D)。
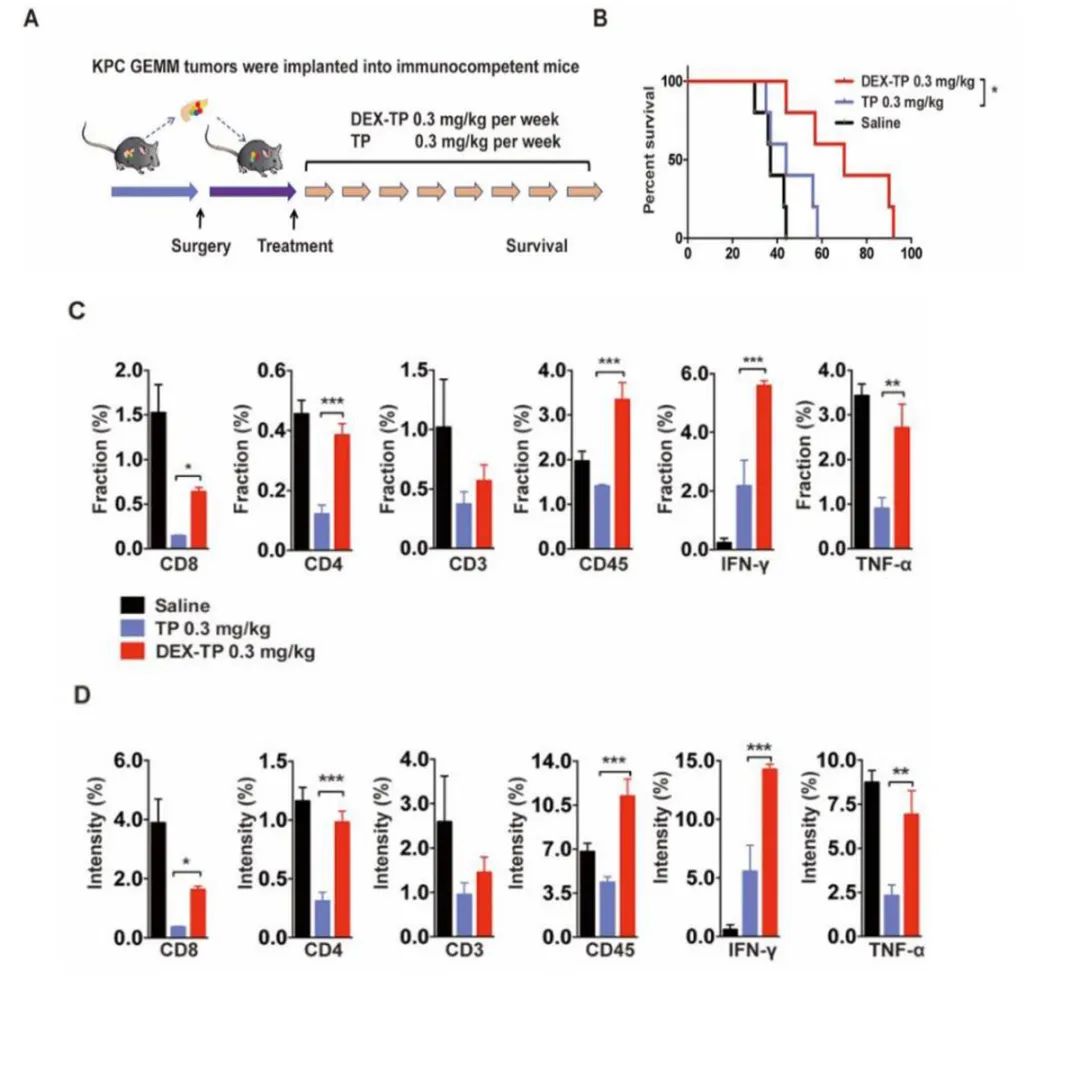
图4 DEX-TP对KPC异体移植原位肿瘤模型的治疗作用
目前虽然通过比较不同分子量的葡聚糖,筛选出了70kDa的Dextran能够更有效地靶向KRAS突变癌细胞进行药物递送,但是这一结果缺乏在物理化学和分子生物学层面的理论研究支持。不同分子量的葡聚糖是由于何种原因,如分子半径、侧链分布、表面电荷、细胞表面作用蛋白等因素导致了在细胞内吞过程中行为的差于尚且没有研究清楚。
为了更深入地研究导致细胞内吞过程中载体地选择性问题,之后通过利用更全面的研究手段,如透射电镜和动态激光散射确定不同分子量葡聚糖的分子半径,表面电荷。通过对细胞不同的内吞方式进行选择性抑制,鉴别各种分子量的葡聚糖主要的入胞方式。在此基础上更清晰地解释在癌细胞内吞过程中药物大分子本身性质所导致的生物学行为差异。


