抗癌药物耐药无疑是相关患者最痛苦的事。全球销售额排名前20的依鲁替尼(Ibrutinib)是近年来治疗淋巴瘤和慢性淋巴细胞性白血病的明星分子,即使是这样疗效显著的靶向药也难以避免耐药的发生。2019年3月19日,白菜网注册领取体验饶燏课题组与北京大学肿瘤医院朱军课题组,以及生科院刘万里课题组合作在血液学国际著名期刊《白血病》(Leukemia)在线发表了最新研究成果《利用PROTAC技术降解多种突变型BTK蛋白克服ibrutinib耐药的非霍奇金淋巴瘤的潜在治疗方案》(Degradation of Bruton’s tyrosine kinase mutants by PROTACs for potential treatment of ibrutinib-resistant Non-Hodgkin lymphomas)。该论文通过构建新型高溶解度的BTK蛋白高效降解剂,成功高效的降解多种临床相关的突变型BTK蛋白,克服了临床上非霍奇金淋巴瘤由于BTK蛋白突变引起的对临床一线药物ibrutinib的耐药性。更为重要的是,新策略克服肿瘤耐药的有效性得到了体内实验的验证。
Bruton's tyrosine kinase(BTK)属于非受体型酪氨酸蛋白激酶,在B淋巴细胞信号通路(BCR)上游部分发挥着重要作用。作为Tec激酶家族的一员,BTK在B淋巴细胞分化和发育中起到关键作用。除了T淋巴细胞和自然杀伤细胞,BTK只在造血细胞中有表达。在生物体中,BTK蛋白发挥了非常重要的生理功能。1952年美国儿科专家Ogdon Bruton发现如果在儿童体内缺乏某种抗体,就会导致X-相关血中丙球蛋白贫乏症(XLA),导致复发性的细菌感染和败血症。1993年,导致X-相关血中丙球蛋白贫乏症的基因被最终确认,在人体中,如果基因组中缺乏BTK基因,会导致B细胞数明显下降,并且伴有血清丙种蛋白水平下降。
在活化的外周血B细胞样(activated B-cell-like,ABC样)弥漫大B细胞淋巴瘤(DLBCL)中,BTK在这类细胞的免疫逃逸中发挥着重要作用。BTK蛋白是首例在发现的在细胞凋亡方面具有双功能条件作用的TEC家族激酶,在B淋巴细胞中能够促进自由基引发的细胞凋亡,但是却能够抑制Fas活化的细胞凋亡。在BCR的通路上,BTK蛋白是受酪氨酸蛋白激酶LYN和脾酪氨酸激酶SYK激活的,当BTK蛋白活化后,即可激活下游蛋白PLC-γ2,然后促进内源性钙离子、甘油二酯(DAG)、三磷酸肌醇(IP
3)的释放,最终激活细胞核因子(NF-κB)的活化,从而抑制B淋巴细胞的凋亡,并且促进癌症的发生。
非霍奇金淋巴瘤(NHL)是B细胞恶性肿瘤的一种,仅美国每年新增病例6万余人。弥散性大B细胞淋巴瘤(DLBCL)是NHL中最常见的一种,在美国和英国每年的发病率高达0.08%。套细胞淋巴瘤(MCL)作为NHL的一种,5年生存率小于50%。BTK共价抑制剂ibrutinib一直是治疗多种非霍奇金淋巴瘤的一线用药,包括套细胞淋巴瘤、慢性淋巴细胞白血病、华氏巨球蛋白血症。2018年,ibrutinib的全球销售额是44.5亿美元,比2017年增长39.4%。尽管如此,根据最新的临床数据报道,针对ibrutinib已经出现了严重的耐药性。由于BTK蛋白481位半胱氨酸突变为丝氨酸(C481S),使得ibrutinib的活性下降近500倍,临床数据已经证明这一突变是病人产生对ibrutinib耐药的根本原因。并且证明,BTK蛋白481位其他突变也会引起ibrutinib失效。
饶燏课题组致力于探究细胞内靶向蛋白质降解技术(proteolysis-targeting chimeras,PROTAC),以及将PROTAC技术转化为临床相关的抗肿瘤活性分子,并于近年来取得了系列重要研究进展:
2018年合作在《Cell Research》期刊率先报道了通过构建新型BTK蛋白高效降解剂,克服了临床上B细胞恶性肿瘤由于BTK蛋白突变引起的对临床一线药物Ibrutinib的耐药性,新策略的靶向选择性远优于Ibrutinib,能够避免Ibrutinib产生的严重副作用;
2018年合作在《ChemComm》报道了利用了不同的招募PARP1蛋白和E3连接酶的配体组合,实现了利用PROTAC技术靶向降解PARP1蛋白;
2019年合作在《Protein & Cell》期刊报道通过构建新型HDAC6选择性的高效降解剂,实现了在多种肿瘤细胞系中对HDAC6的高效降解,且该降解剂能够降解EGFP融合蛋白,证明可以利用荧光手段在细胞层面实现蛋白降解过程的动态监测;
2019年合作在《Cell Discovery》报道通过化学设计蛋白降解分子(PROTACs),快速可逆敲低动物体内蛋白(FKBP12),并首次成功实现恒河猴体内蛋白全身快速敲降;
2019年合作在《Leukemia》报道通过构建新型高溶解度的BTK蛋白高效降解剂,成功高效的降解多种临床相关的突变型BTK蛋白,在体内实验中克服了临床上非霍奇金淋巴瘤由于BTK蛋白突变引起的对临床一线药物ibrutinib的耐药性。
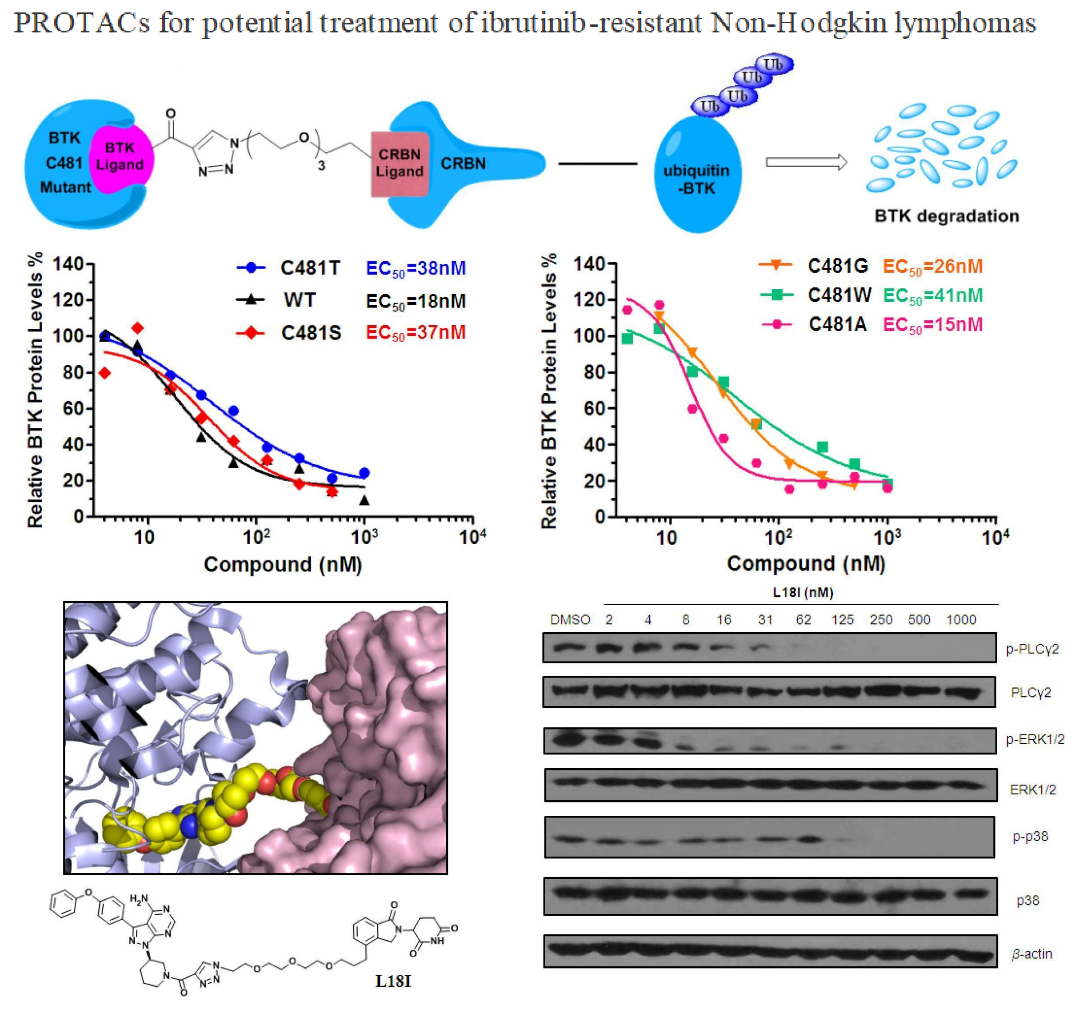
饶燏课题组通过构建全新骨架的PROTAC小分子,招募E3泛素化连接酶靶向降解BTK蛋白。新构建的BTK蛋白降解剂可以在转染的HeLa细胞中以小于50 nM的药物浓度高效降解多种突变类型(C481S/T/A/G/W)的BTK蛋白。更为重要的是,新策略可以引起突变型DLBCL肿瘤内BTK蛋白水平的降低,从而在体内有效抑制肿瘤的生长,克服肿瘤BTK激酶由于C481位点突变引起的对临床一线药物ibrutinib的耐药性。除此之外,本研究还针对BTK蛋白下游信号进行了探索,如PLC-γ2、p38及ERK1/2,明确了新型PROTAC分子作用于BTK蛋白后引起的细胞下游信号的改变,从机制层面上阐述了新策略发挥抗肿瘤效果的原因。
除治疗DLBCL外,新型PROTAC小分子也可以有效抑制MCL(mino及Z138),其效果优于目前临床一线药物ibrutinib。本研究的另一大亮点是将PROTAC策略与传统小分子抑制剂联用,如copanlisib、dasatinib等,大大提高了PROTAC策略的抗肿瘤效果。
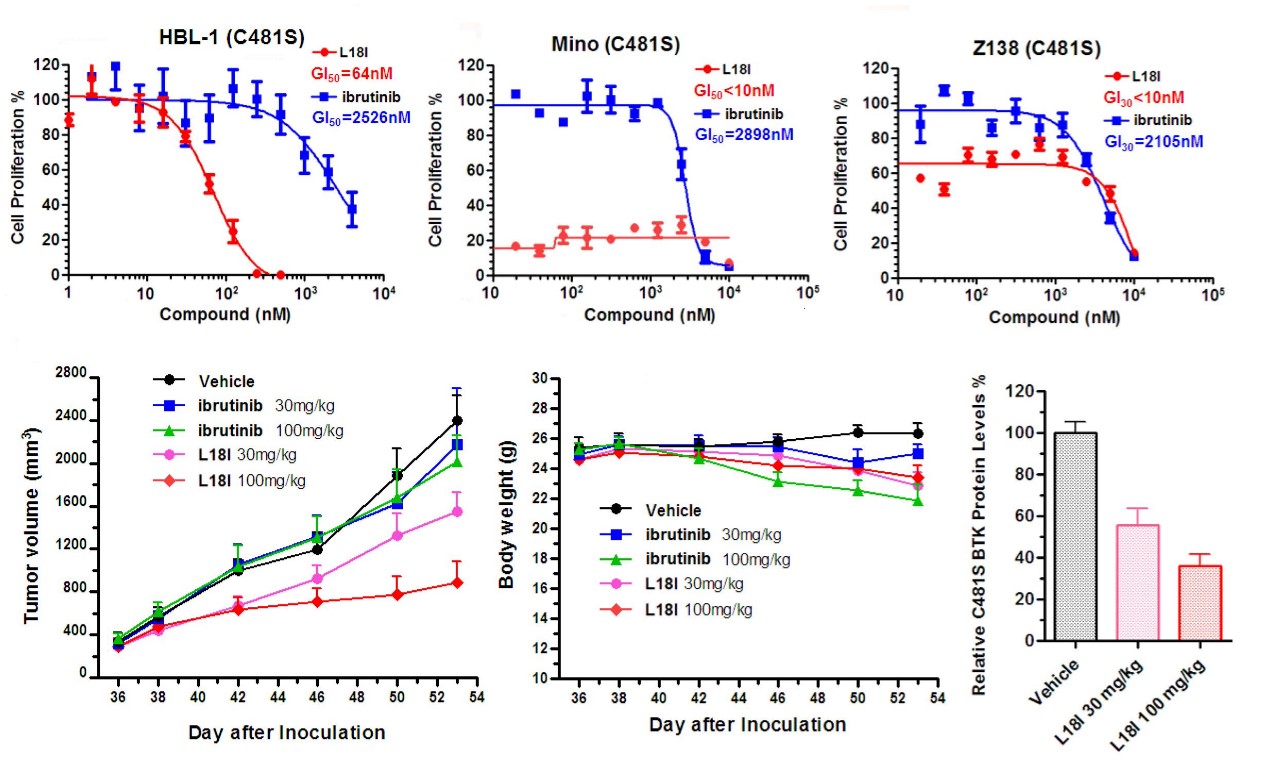
该工作为基于PROTAC进行抗耐药非霍奇金淋巴瘤的药物研发提供了重要信息,目前该团队研究人员在进一步进行此类新型化合物的开发工作,希望继续提高其代谢稳定性及抗肿瘤效果。
白菜网注册领取体验饶燏教授、朱军教授和刘万里教授为本论文共同通讯作者。饶燏课题组博士生孙永汇、北京大学肿瘤医院副研究员丁宁以及北京大学肿瘤医院研究员宋玉琴为本文并列第一作者。该研究得到了国家自然科学基金以及国家重大新药创制项目的资助,同时也得到了北京自然科学基金的大力支持。
原文链接
https://www.nature.com/articles/s41375-019-0440-x


