2020年4月22日饶燏课题组与武汉大学宋保亮课题组合作在
Journal of Medicinal Chemistry 发表题为“Degradation Versus Inhibition: Development of Proteolysis-Targeting Chimeras for Overcoming Statin-Induced Compensatory Upregulation of 3-Hydroxy-3-methylglutaryl Coenzyme A Reductase”的研究工作。HMGCR(3-Hydroxy-3-methylglutaryl Coenzyme A Reductase)是胆固醇(cholesterol)合成途径中的限速酶,并且是经典的治疗血脂异常的药物靶点。它的抑制剂(statin, 他汀类化合物)如阿伐他汀(atorvastatin, 立普妥®,辉瑞)在临床被用于预防和治疗心血管疾病,并取得了极大的成功。但是有相当一部分人对他汀类药物不耐受,比如会发生骨骼肌损伤等较为严重的副作用,这有可能与服用他汀类药物后体内通过负反馈调节导致HMGCR补偿性表达升高有关。因而在该工作中,研究人员利用蛋白靶向降解嵌合体(Proteolysis-Targeting Chimera, PROTAC)的技术对HMGCR在进行降解而起到抑制胆固醇合成作用的同时可以避免HMGCR的高表达,从而有望降低副作用。
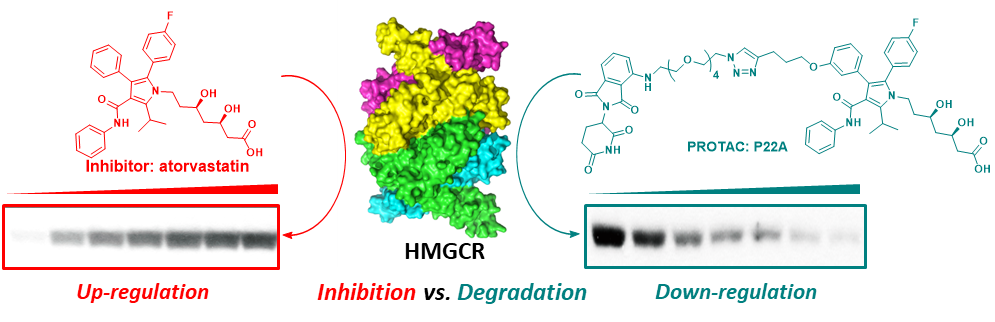
图1. 抑制剂与PROTAC对HMGCR的影响
在该工作中,研究人员首先筛选出SRD15细胞系作为细胞测试的基础,然后基于HMGCR的配体阿伐他汀和E3链接酶CRBN的配体泊马渡胺进行了一系列的构效关系研究,发现化合物P22A作为PROTAC具有较好地降解活性(DC
50~100 nM)。相比之下,抑制剂阿伐他汀对HMGCR引起了明显的上调作用(图1)。
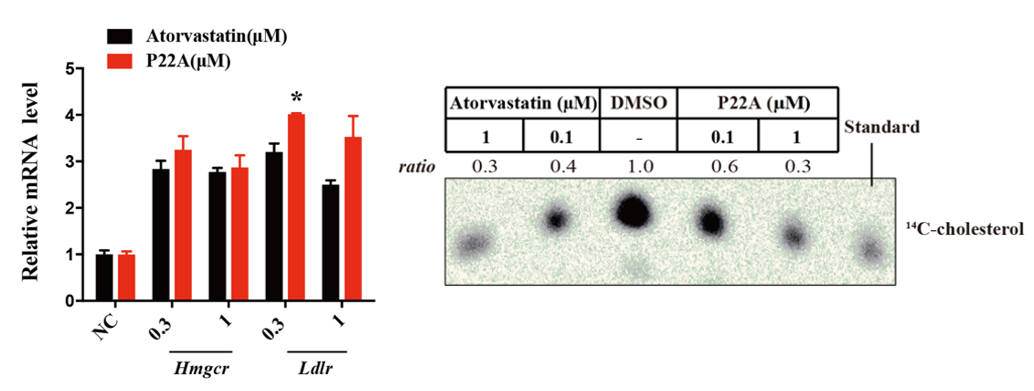
图2. 抑制剂和PROTAC对LDLR和胆固醇的影响
接下来,研究人员通过一系列的生化和细胞生物学实验证实了PROTAC通过泛素-蛋白酶体系统发挥作用的机制;通过蛋白组学的研究发现抑制剂和PROTAC引起的组学应答也有很大不同。抑制剂和PROTAC对胆固醇合成抑制和通过SREBP通路引起的低密度脂蛋白受体(LDLR)表达水平上调的能力相当(图2)。
HMGCR是位于内质网上的八次跨膜蛋白, PROTAC对此类蛋白的降解能力往往有限,该工作首次证明利用PROTAC技术对内质网蛋白进行降解的可行性。另外,靶蛋白上调的现象还出现在很多其它的抑制剂中,该工作展示了面对此种情况时是PROTAC一个很好的应用场景。
宋保亮组博士生李美欣和饶燏组博士后杨毅庆为本工作共同第一作者,饶燏和宋保亮组罗婕为共同通讯作者,本研究得到了国家自然科学基金、清华-北大生命联合中心以及中国博士后基金的大力支持。
原文链接:https://pubs.acs.org/doi/10.1021/acs.jmedchem.0c00339


