2021年2月17日,白菜网注册领取体验肖百龙研究组应邀在国际知名学术期刊Trends in Biochemical Sciences发表题为《机械敏感Piezo通道的结构设计和机械门控机制》(Structural Designs and Mechanogating Mechanisms of the Mechanosensitive Piezo Channels)的综述文章,系统总结了哺乳动物机械门控离子通道Piezo1和Piezo2自2010年被发现报导以来的重要研究进展,包括其重要的生理病理功能、生物物理及药理学特性、精巧的结构设计和独特的机械门控机制,并对其进一步的深入研究进行了展望。
 Piezo通道的发现与证实
Piezo通道的发现与证实
人是如何感受力的?我们如何感知同事的握手、母亲的轻抚,这些看似简单的问题,科学家们致力于寻找答案。细胞,作为生物功能的基本单元,能够感知并响应机械力,有的细胞在机械力的刺激下,可以产生兴奋性电流并伴随钙离子的内流,但介导这一细胞学现象的蛋白分子长久以来未被发现。直到2010年,Ardem Patapoutian团队首次鉴定发现介导哺乳动物机械力敏感阳离子电流的Piezo基因家族,包括Piezo1和Piezo2两个成员(Coste et al., Science 2010)。随后于2012年,在Patapoutian团队从事博士后研究的肖百龙博士与其同事合作证明了Piezo蛋白是机械门控阳离子通道的核心孔道亚基,从而首次证实确立了机械门控Piezo通道这一全新离子通道家族(Coste, Xiao et al., Nature 2012)。发现与证实Piezo通道的研究成果已经被收录进由美国斯坦福大学教授骆立群博士主编的《神经生物学原理》(Principles of Neurobiology)教科书。
Piezo1与Piezo2在多种细胞类型中介导机械传导过程
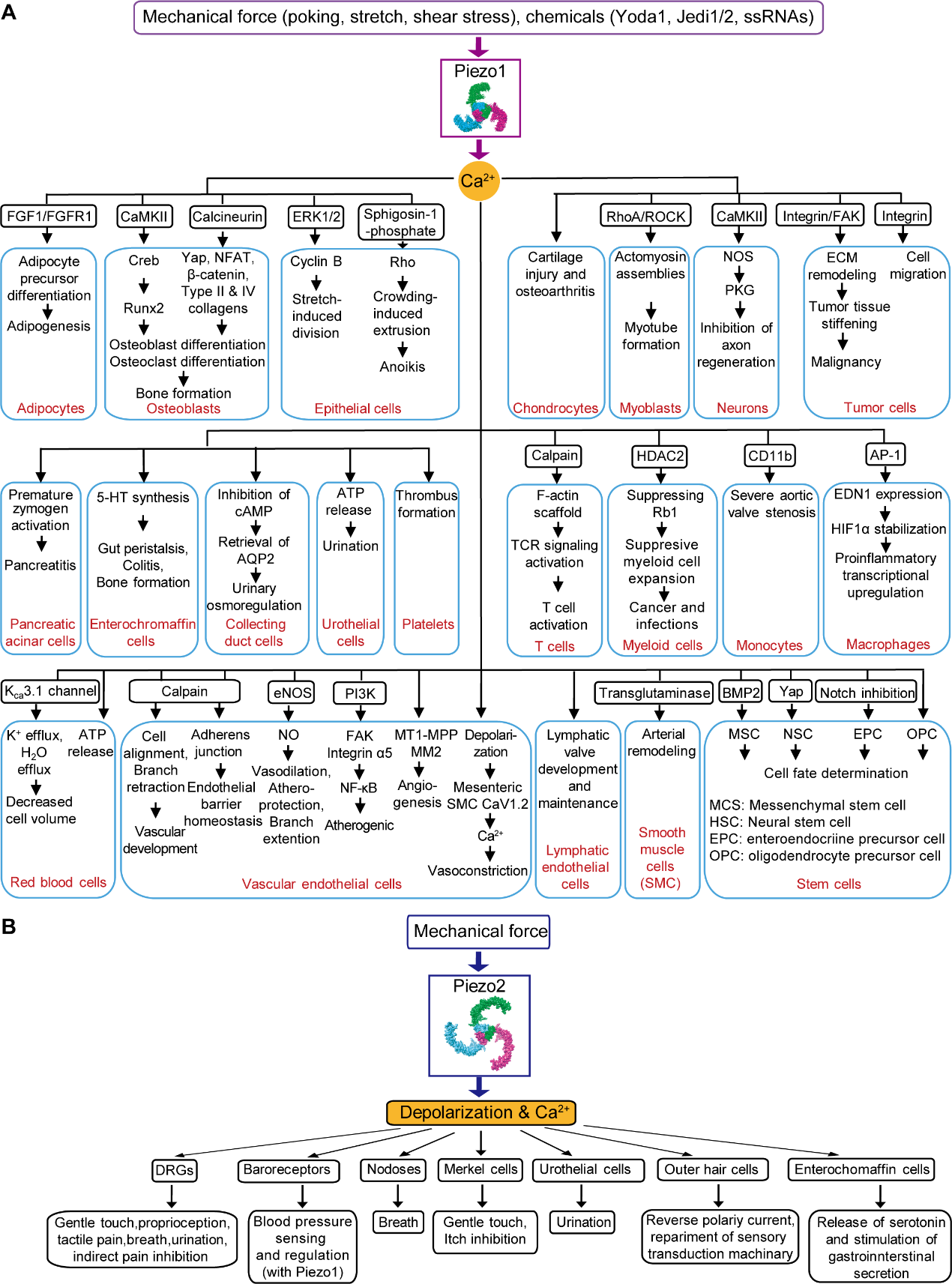
图 1 Piezo通道在多种细胞类型中的表达与功能
Piezo1主要是表达在非神经元细胞中,而Piezo2则主要表达在初级感觉神经元细胞。Piezo1作为一种通用的机械传导通道,在不同的细胞类型中通过介导不同的Ca²⁺信号通路从而承担多种细胞学功能。Piezo1介导的机械转导与心血管发育与功能、红细胞体积调节、肾功能、骨形成和重塑、轴突再生、先天免疫、脂肪炎症和脂肪生成、压力性胰腺炎、肠道蠕动和结肠炎等多种生理病理过程相关。Piezo2是启动初级感觉神经元和特殊细胞类型(如麦克尔细胞)去极化的主要机械传导通道,介导轻微触碰、触摸痛、本体感受、呼吸道伸展和肺膨胀、血压反射弧调控(连同Piezo1)、低阈值膀胱伸展和尿道排尿等生理病理功能。Piezo2还被发现可抑制机械性瘙痒和疼痛(图 1)。Piezo2在触觉感知上的重要作用在人类、小鼠、大鼠、星鼻鼹、鸟类、斑马鱼等多种物种上被证实。
Piezo通道的结构基础研究
Piezo通道的结构特征
面对如此重要的机械力分子受体蛋白,科学家们好奇究竟是怎样的结构基础,赋予了它们高效感知机械刺激并把其转化为电化学信号的能力?肖百龙课题组与其合作者利用单颗粒冷冻电镜技术,首次解析报导了Piezo1、Piezo2以及由其课题组所鉴定发现的Piezo1剪切变体-Piezo1.1的三维结构,并利用电生理膜片钳、生化、药理学等研究手段对其结构功能关系进行了深入系统的研究,创新性提出了Piezo通道进行机械门控的功能区模块化作用机制假说、杠杆作用机制假说、双门控作用机制假说、以及门塞和闩锁作用机制假说,不仅有力驱动了对Piezo通道这类全新离子通道家族的深入理解,也为基于Piezo离子通道的新型药物与技术的开发奠定了坚实的基础(Nature 2015,2018,2019; Neuron 2016,2020; Nature Communications 2017,2018; Annual Reviews of Pharmacology and Toxicology 2020)。其与李雪明课题组合作解析的Piezo1的高分辨率结构(Nature 2018)已经被收录进《神经生物学原理》(Principles of Neurobiology)教科书。
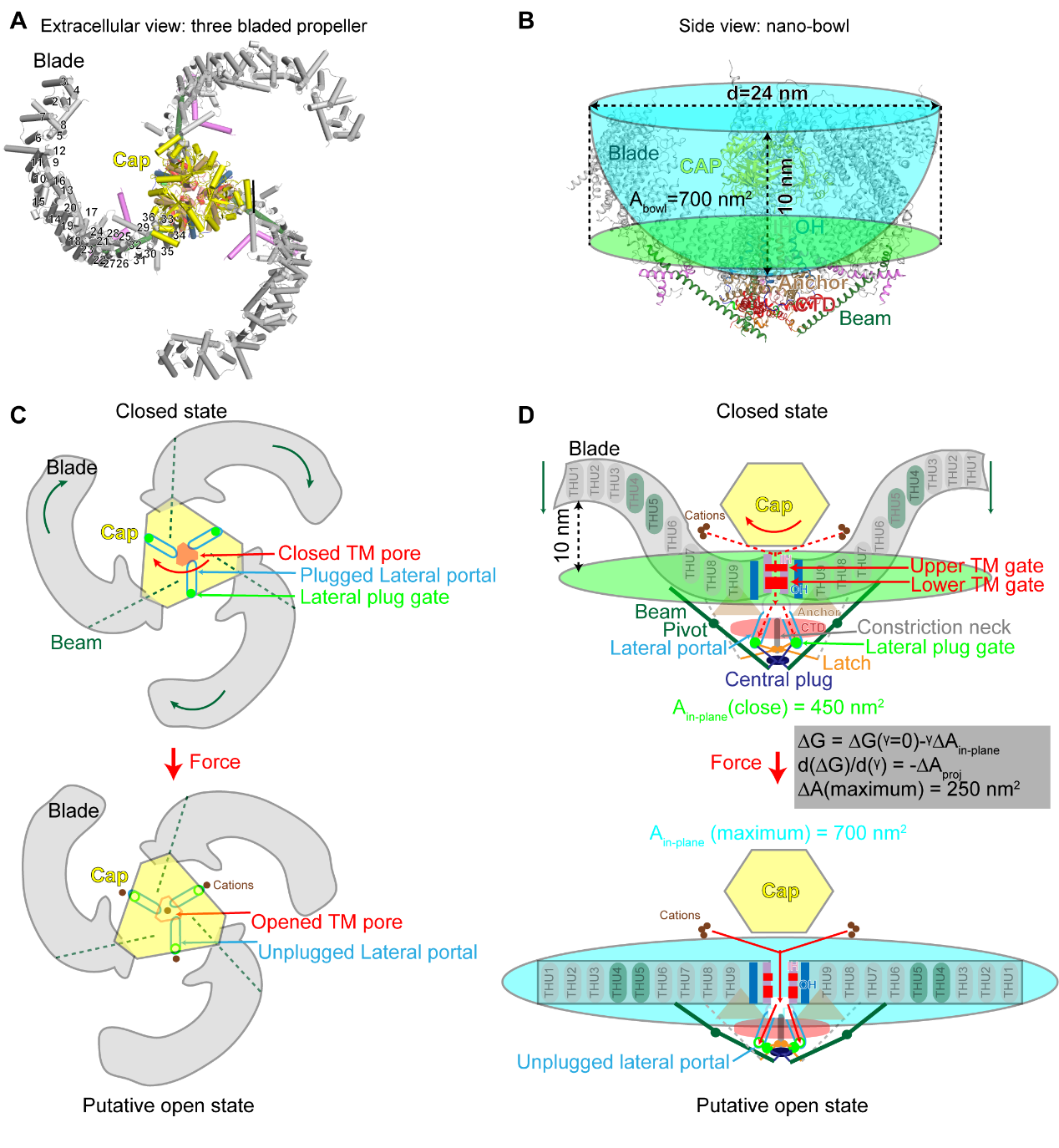
图 2 同源三聚体Piezo通道的三维结构和机械门控机制模型
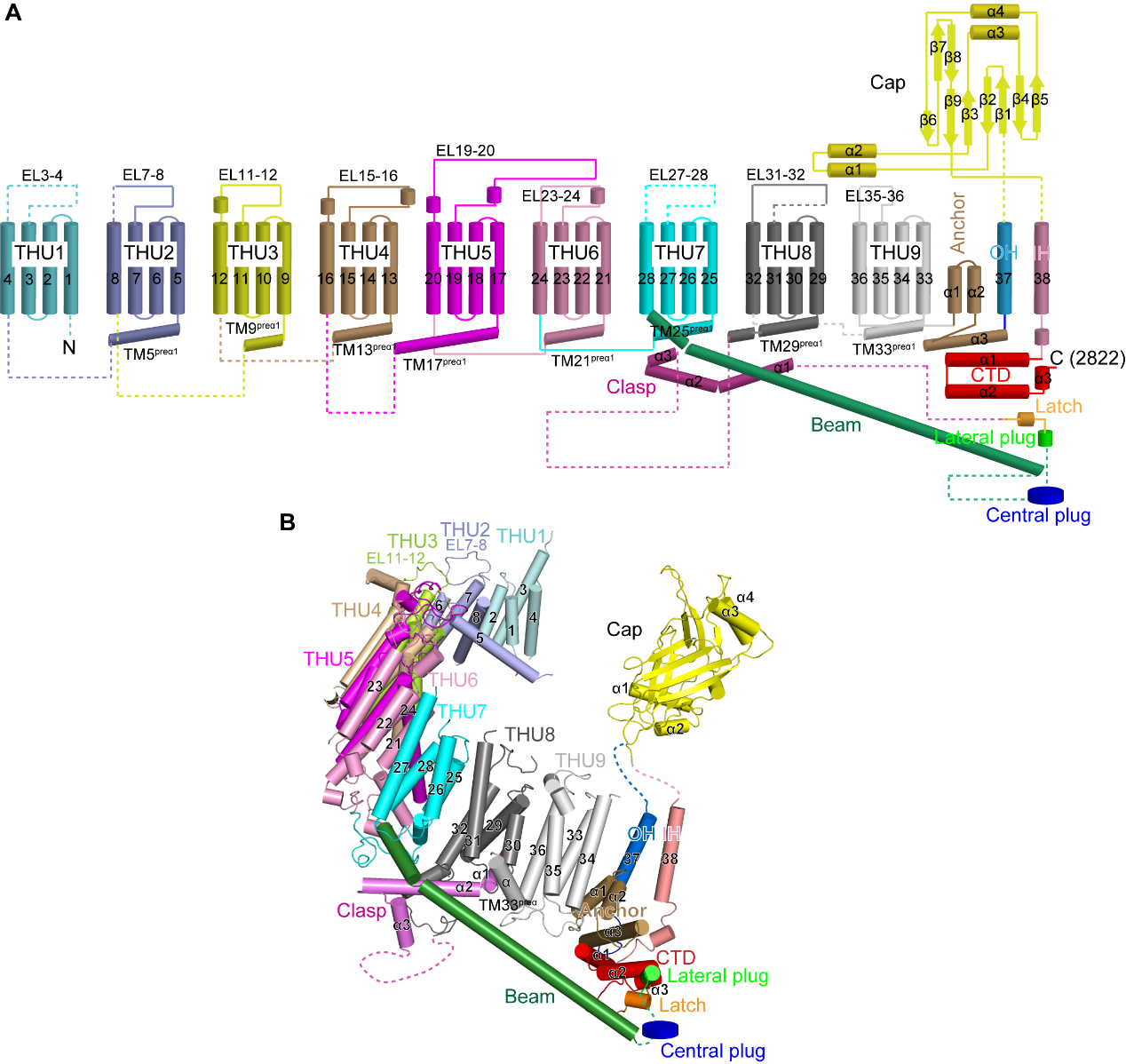
图 3 Piezo2蛋白的38次跨膜螺旋拓扑结构
Piezo1与Piezo2形成“巨大”的三聚体三叶螺旋桨结构:它们的蛋白单体含有38次跨膜螺旋,通过同源三聚形成离子通道,其中每个单体羧基端的2个跨膜区通过三聚化形成中心孔道区,而氨基端36个跨膜螺旋以4次跨膜区为单元组装成共9个重复性的结构单元(THU),从中心孔道区向外伸展,形成桨叶结构(图 3)。如此独特的结构使得Piezo1/2的三聚体离子通道一共拥有114次跨膜螺旋区,为已知含跨膜螺旋区最多的离子通道。更加引人注目的是,这114个跨膜区并非处于一个平面上,而是形成直径24 nm,深9 nm的碗状凹陷结构,研究者将其称之为“纳米碗”:其碗面积为700 nm², 而平面内膜面积为450 nm²(图 2A和B)。研究者推测当力作用于细胞膜时,可引起桨叶变平。如果桨叶完全展平,可以将700 nm²的碗面积完全转化成平面内膜面积,引起高达250 nm²的平面膜面积的扩张。由于张力敏感度由膜面积的膨胀变化所决定,因此Piezo通道独特的纳米碗状结构可能是赋予其高度机械敏感性的结构基础(图 2D)。
Piezo通道的门控机制
图 4 包含跨膜孔道和三条胞内侧的侧向离子通透路径的中心孔道模块区
跨膜区孔道由第38次跨膜螺旋围合而成(图3和4A)。所解析的Piezo2通道有一个完全密封的跨膜区孔道,上方有一个收缩部位,下方有一个10Å长的狭窄部位(图4A)。相比之下,所解析的Piezo1结构中相应的两个位置都处于扩张状态。因此,这两个收缩位置被称之为上、下跨膜区孔道闸门(图2D和4A, upper and lower TM gates)。删除整个帽子区域或与桨叶接触的区域,或通过交联限制帽子区域运动会抑制Piezo通道的激活。这些研究表明上、下跨膜区孔道闸门的激活是由帽子区域来控制的。结构和功能分析还表明,三个胞内的侧向离子通透路径连接到中心孔区,从而充当细胞内离子传导途径(图2C、D和4B-D)。有趣的是,三个侧向离子通透路径的出口被三个门塞分别堵住。对剪切突变体Piezo1.1的冷冻电镜结构解析发现Piezo1.1正好缺失这三个门塞的区域,使得三个侧向离子通透路径的出口被打开(图 4D)。基于结构功能分析,肖百龙课题组提出了Piezo通道利用类似门塞和闩锁(plug-and-latch)的作用原理对其胞内侧离子通透路径进行门控的精巧分子机制。
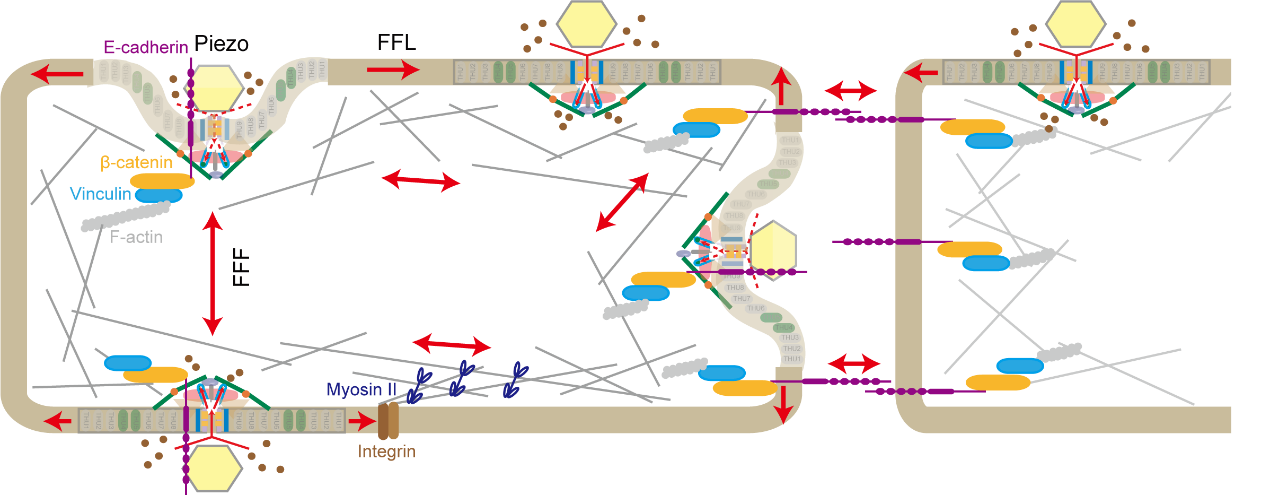
图 5 Piezo离子通道可整合以细胞膜张力感知为基础的脂膜张力模型(force-from-lipids, FFL)以及E-Cadherin介导的以细胞骨架结构为基础的栓绳拉力模型(force-from-filament,FFF)来协同实现机械门控
Piezo离子通道可整合以细胞膜张力感知为基础的脂膜张力模型(force-from-lipids, FFL)以及E-Cadherin介导的以细胞骨架结构为基础的栓绳拉力模型(force-from-filament,FFF)来协同实现机械门控。E-Cadherin的胞外区与Piezo1的帽状结构域的直接相互作用,以及E-Cadherin蛋白的胞内C端与Piezo1的细胞内门控元件的直接相互作用构成了来自骨架的栓绳拉力模型的结构基础,通过E-Cadherin-β-catenin-vinculin-F-actin机械传导复合物,Piezo通道可以实现细胞内或细胞间的长距离机械传导。相比之下,局部膜张力引起的高度弯曲的跨膜桨叶平面化可能构成来自脂膜的力模型的结构基础(图 5)。
自10年前被发现以来,Piezo通道的重要生理病理功能在包括人类自身的多种物种中得以证实。同时,结构-功能研究揭示了其独特的结构特征和精巧的门控机制,使Piezo通道利用精巧的机械传导机制,有效地将机械力刺激转化为细胞信号。尽管目前为止有关Piezo通道的研究已经取得了显著进展,但仍有许多悬而未决的问题有待解决。譬如,随着对决定Piezo通道机械敏感性和离子通透的关键功能位点的鉴定发现,可以通过构建定点突变的敲入小鼠模型,进而探究Piezo通道如何利用其通道特性来精确决定其所控制的各种机械传导过程。鉴于Piezo通道的特征性纳米碗结构和所提出的门控机制假说,研究脂质环境中Piezo通道的动态门控机制至关重要。基于对Piezo通道的分子机制和疾病相关性的深入理解,一个极具挑战性的终极目标是开发新的疾病治疗药物,譬如通过抑制Piezo2来开发抑制机械超敏痛(触摸痛)的新型镇痛药物。
白菜网注册领取体验肖百龙研究员为本文通讯作者,其研究组2015级白菜网注册领取体验博士研究生江艳、2019级CLS项目博士研究生杨旭中、2017级白菜网注册领取体验博士研究生姜京徽为本文共同第一作者。本研究得到了国家自然科学基金重点项目(31630090)、杰出青年科学基金(31825014)、以及国家重点研发计划(2016YFA0500402, 2015CB910102)、清华-北大生命科学联合中心、北京市高精尖结构生物学中心、膜生物学国家重点实验室的资助。
论文链接:https://doi.org/10.1016/j.tibs.2021.01.008


