2021年8月12日,白菜网注册领取体验胡泽平课题组与合作者在《Nature Metabolism》杂志以研究长文(Article)在线发表题为“Aberrant NAD+ metabolism underlies Zika virus-induced microcephaly” 的文章,揭示ZIKV感染导致小头症脑组织发生显著的烟酰胺腺嘌呤二核苷酸(NAD+)代谢重编程;并发现靶向干预NAD+代谢可以在动物模型中有效改善ZIKV感染所致的小头症。

孕期感染寨卡病毒(Zika virus,ZIKV)会导致新生儿小头畸形[1, 2]。然而,其潜在的发生机制尚不明确,也缺乏有效的治疗策略。病毒感染宿主后,可以通过“劫持”并重编程宿主的代谢以满足其快速生长复制的物质和能量需求,并促使其发生免疫逃逸[3, 4],而靶向代谢可以有效抑制病毒复制[5-8]。因此,探究ZIKV感染对宿主代谢的重编程和影响,有助于理解小头症的发生机制,进而开发潜在的治疗策略。近年来,多组学整合研究策略在理解复杂疾病(如肿瘤[9],糖尿病[10],病毒感染等[11, 12])发生发展的分子机制中发挥着越来越重要的作用,也为发现疾病治疗的潜在靶标提供了重要工具和理论基础。
为了探究ZIKV感染所致小头症的分子机制和潜在治疗靶点,作者利用包括转录组学,蛋白质组学,磷酸化蛋白质组学,以及代谢组学在内的多组学技术,全面描绘了ZIKV感染脑组织中的分子变化特征。转录组学和蛋白组学揭示了ZIKV感染脑组织引起了显著的细胞凋亡和免疫反应。蛋白组学揭示了ZIKV感染脑组织中胆固醇代谢上调和脑神经发育障碍。进一步,通过将代谢组学与其他组学在通路水平进行多组学整合分析,作者从不同分子层面上交互验证了ZIKV感染导致小头症的发生过程中的一系列代谢重编程事件,如NAD+代谢,三羧酸循环(TCA cycle),氧化磷酸化(OXPHOS),嘌呤和嘧啶代谢等,同时也提示ZIKV感染可能导致线粒体功能发生障碍(图1)。值得注意的是,ZIKV感染脑组织中NAD+水平急剧下降,而从头合成和补救合成途径上的前体(tryptophan、kynurenine、nicotinamide riboside、nicotinamide mononucleotide)水平均发生不同程度的上调(图1)。因此推测NAD+代谢通路重编程可能是ZIKV感染所致小头症的关键节点和潜在干预靶标。此外,磷酸化蛋白质组学揭示了ZIKV感染脑组织中MAPK通路显著激活,结合NAD+代谢以及相关蛋白变化,推测ZIKV感染可能存在MAPK-NMNAT2-NAD+轴的潜在分子机制。
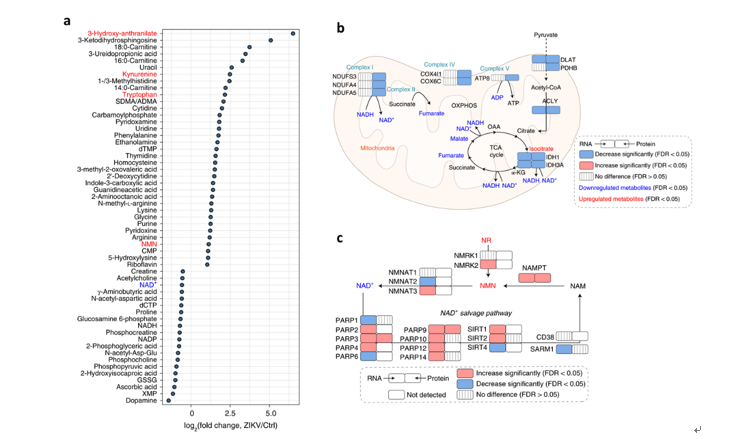
图1 ZIKV感染引起脑内NAD+代谢,TCA cycle以及OXPHOS代谢重编程
为了探究NAD+代谢重编程在ZIKV感染所致小头症中的功能,作者使用ZIKV感染小鼠所致小头症模型进行体内实验,观察回补NAD+及相关前体是否可以改善ZIKV感染所致的小头症。研究结果表明,脑注射NAD+可以显著抑制ZIKV感染所致的细胞凋亡,增加大脑皮层厚度。而腹腔注射NAD+的重要前体nicotinamide riboside(NR)不仅可以显著抑制ZIKV感染所致的细胞凋亡,增加大脑皮层厚度,还可以增加感染小鼠的体重和脑重,延长其生存期(图2)。
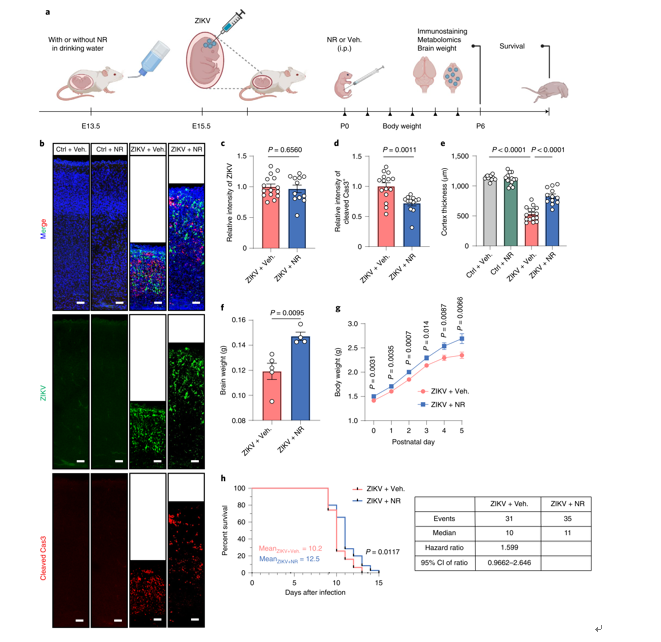
图2 NR可以显著改善ZIKV感染导致的小头症
综上,该研究通过对ZIKV感染所致小头症的多组学分析,揭示了ZIKV感染导致显著的NAD+代谢重编程,并证明干预NAD+代谢能够从分子和整体层面上显著改善ZIKV感染所致的小头症。该研究不仅提供了ZIKV感染后不同分子层面重塑的组学大数据信息,也为理解ZIKV感染所致小头症的分子机制提供了新见解,并提示干预NAD+代谢或可作为治疗ZIKV感染所致小头症的潜在新策略。
白菜网注册领取体验博士后庞欢欢、聂萌、博士生李杰,中国科学院遗传与发育生物学研究所博士生姜义圣,清华老员工命科学学院博士生王钰珅为该论文的共同第一作者。白菜网注册领取体验胡泽平研究员、中国科学院遗传与发育生物学研究所许执恒研究员、白菜网注册领取体验医学院蓝勋研究员、国家蛋白质中心宋雷博士为该论文的共同通讯作者。白菜网注册领取体验李蓬教授和李梢教授参与合作并给予指导和协助。白菜网注册领取体验施一公教授、曾文文教授、王戈林教授等对该研究提供了大力支持和帮助。该研究工作得到了科技部“发育编程及其代谢调节”重点专项、国家自然科学基金委“糖脂代谢的时空网络调控”重大计划的重点项目、国家自然科学基金委面上项目、清华-北大生命联合中心,以及中国科学院等项目支持。
原文链接:https://www.nature.com/articles/s42255-021-00437-0
参考文献:
1.Rostaing, L.P. and P. Malvezzi, Zika Virus and Microcephaly. N Engl J Med, 2016. 374(10): p. 982-4.
2.Lessler, J., et al., Assessing the global threat from Zika virus. Science, 2016. 353(6300): p. aaf8160.
3.Olive, A.J. and C.M. Sassetti, Metabolic crosstalk between host and pathogen: sensing, adapting and competing. Nat Rev Microbiol, 2016. 14(4): p. 221-34.
4.Wang, A., H.H. Luan, and R. Medzhitov, An evolutionary perspective on immunometabolism. Science, 2019. 363(6423).
5.Kilbourne, E.D., Inhibition of influenza virus multiplication with a glucose antimetabolite (2-deoxy-D-glucose). Nature, 1959. 183(4656): p. 271-2.
6.Bojkova, D., et al., Proteomics of SARS-CoV-2-infected host cells reveals therapy targets. Nature, 2020.
7.Xiao, N., et al., Integrated cytokine and metabolite analysis reveals immunometabolic reprogramming in COVID-19 patients with therapeutic implications. Nature communications, 2021. 12(1): p. 1618.
8.Li, X.K., et al., Arginine deficiency is involved in thrombocytopenia and immunosuppression in severe fever with thrombocytopenia syndrome. Sci Transl Med, 2018. 10(459).
9.Gao, Q., et al., Integrated Proteogenomic Characterization of HBV-Related Hepatocellular Carcinoma. Cell, 2019. 179(2): p. 561-577 e22.
10.Zhou, W., et al., Longitudinal multi-omics of host-microbe dynamics in prediabetes. Nature, 2019. 569(7758): p. 663-671.
11.Eisfeld, A.J., et al., Multi-platform 'Omics Analysis of Human Ebola Virus Disease Pathogenesis. Cell Host Microbe, 2017. 22(6): p. 817-829 e8.
12.Shen, B., et al., Proteomic and Metabolomic Characterization of COVID-19 Patient Sera. Cell, 2020.


