针对或利用疾病的生物学特征,本验室致力于设计和评估针对胰腺癌、老年黄斑病变等疾病的新型药物和药物递送体系,以期获得具有更好的疗效,并可临床和工业转化的新型药物,从而满足亟待解决的临床需求。
在化学药物和多肽药物领域,本实验室长期研究新型制剂的设计策略,用于提高不符合“rule of five”的新药分子的口服生物利用度。在蛋白药物领域,本课题组的研究兴趣为研究设计用于皮下和局部注射用的高浓度蛋白制剂。
1. “药物-材料-水”的分子间相互作用对制剂结构和行为的影响:
作为一个热力学不稳定体系,无定形药物-高分子固体分散体(amorphous solid dispersion, ASD)的物理稳定性是这一制剂的主要风险之一。 我们提出了设计ASD的工作路线图,以降低ASD的稳定性风险。这一思路被业内同行广泛认可。 此外,我们提出“药物-材料-水”的分子间相互作用是决定ASD药学表现的核心影响因素,并且建立了表征“药物-材料-水”三者相互作用的方法学。我们还通过体内外实验明确证明了药物-材料的相互作用对药物制剂的溶出,生物利用度的影响。以上这些工作对难溶药物的制剂设计和优化具备重要应用意义。
2. 针对KRAS突变的癌症细胞的药物递送策略:
KRAS突变被认为很难以进行靶向药物设计。我们提出了一种靶向KRAS突变癌症细胞的药物递送策略。这一策略的提出是基于KRAS突变癌症细胞不同于KRAS野生型正常细胞的生物学特点,即,增强的巨胞饮和低表达的FcRn受体。在药物递送领域内,利用疾病生物学机制,靶向特定基因型细胞的药物递送是一个全新的尝试。
3. 高浓度蛋白的聚集动力学和溶液稳定性机制:
皮下和局部注射蛋白药物,常常需要很高浓度的蛋白溶液制剂。在高浓度下,蛋白分子相互作用变得更为复杂,对蛋白的结构和胶体稳定性都可带来负面影响,并加速不可逆的蛋白聚集,导致药效降低、产品表观质量下降、病人过敏反应而降低用药的安全性。高浓度蛋白溶液的设计和风险评价一般都是以试错方式进行的。我们尝试从物理化学、胶体科学层面探究影响蛋白溶液相分离和聚集的关键因素和动力学过程,为高浓度蛋白制剂设计提供理论依据。
研究成果
1. “药物-材料-水”的分子间相互作用对制剂药剂学行为的影响:
我们在2015年提出了研究“药物-材料-水”的方法学,“χASD-water plot”(ASD和水的Flory-Huggins相互作用参数相对于ASD的载药量的变化, 图1),我们发现这一表征手段可以清晰揭示ASD中药物和高分子的相互作用强度、种类、以及在水作用下的变化,并且发现这些分子间相互作用和ASD的溶出密切相关。 当药物-高分子相互作用使得体系更为疏水,且这一相互作用不为水所破坏时,ASD表现出最佳溶出效果。这一工作首次确认了分子间相互作用和制剂溶出行为的关联。随后,我们在多个研究中验证了药物和材料之间的分子间相互作用,对制剂结构和表现的影响,这样的分子药剂学的研究思路也支持了多个新药的制剂研发。(Mol. Pharmaceutic, 2016, 13, 599–608; Mol. Pharmaceutic, 2016, 13, 2787-2795;Pharm Res, 2016, 33(10), 2445-2458;Cryst. Growth Des., 2016, 16, 5367-5376;Mol. Pharmaceutics, 2018, 15 (7), 2754–2763;Mol. Pharmaceutics, 2019, 16(1), pp 318–326; ACS Infect. Dis. 2020, 6, 5, 802–810;etc.)

图1. 六种ASD体系(G, F, K 为三种模型药物,P, H 分别为PVP-VA和HPMC-AS两种高子)的χASD-water和ASD载药量的关系。 这一图示预测了不同ASD的溶出表现,从而为ASD制剂的设计提供了清晰的理论指导。(Molecular Pharmaceutics, 2015,12(2):576-89.)
2. 针对KRAS突变癌症的药物递送:
虽然药物化学家在设计靶向KRAS抑制剂方面已经取得了不少进展, 突变的KRAS(特别是G12D,G12V,等)仍然被认为是难以成药的靶点。我们提出了一种针对KRAS突变癌症细胞的药物递送策略。基于KRAS突变细胞增强的巨胞饮,和FcRn受体低表达的生物学特征, 我们发现,白蛋白偶联的药物,在维持白蛋白天然结构的情况下,将显著依赖巨胞饮方式进入KRAS突变的癌细胞,入胞后通过溶酶体降解路径,在缺少FcRn结合保护的情况下有效释放出药物载荷;与KRAS突变的胰腺癌细胞形成鲜明对比的是,KRAS野生型的正常上皮细胞以网格蛋白介导内吞的方式摄取白蛋白偶联药物,入胞后由于其与FcRn受体的紧密结合被迅速分选至循环小泡,继而被胞吐出胞。我们发现,受益于这种在不同KRAS基因型下内吞转运表型的差异,白蛋白偶联药物可以显著提高(~10倍)药物载荷的治疗窗口。白蛋白偶联药物这一策略提供了一种利用药物递送手段获得KRAS细胞靶向的可能(图2)。我们同时探索了其他具备KRAS靶向特点的药物递送系统,以及针对KRAS突变胰腺癌肿瘤微环境的药物递送系统,并基于相关的发现,探索开发一系列针对KRAS突变肿瘤,特别是胰腺癌,的新型药物递送策略 (Cancer Letters, 2022,539, 215718;Theranostics. 2022; 12(3): 1061-1073;J Control Release. 2020;323(March):311-320;Advanced Therapeutics. 2019, 1900032, ACS Nano, 2019 23;13(4):4049-4063; Small, 2018 Dec;14(51):e1802112,etc.)
图2. 白蛋白药物偶联物的细胞内吞转运机制示意图 。(J Control Release.2019;296(January):40-53.)
3. 高浓度蛋白的聚集动力学和溶液稳定性机制
以单抗(Monoclonal Antibody, mAb)为代表的蛋白药物是当今发展最为迅速的一类生物大分子药物,具有靶向性强、副作用小等优势。由于单抗的高剂量和皮下及局部(比如,玻璃体内)注射小体积需求,其制剂常常是高浓度胶体溶液,使得单抗分子在制剂中的相互作用变得更为复杂,对单抗的结构和胶体稳定性都可带来负面影响,并加速不可逆的单抗聚集,导致药效降低、产品表观质量下降、病人过敏反应而降低用药的安全性。我们致力研究单抗聚集动力学基础和稳定性机制,并探索开发新型高浓度蛋白药物制剂用于皮下和局部(比如玻璃体内注射)。我们从物理化学、胶体科学层面深度探究了影响单抗溶液相分离和聚集的关键结构因子和溶液理化因素。发现单抗分子在相分离过程中以一级动力学规律聚集成核且不断长大并形成高浓度的单抗液滴,最终沉降形成明显的相分离状态。本研究从单抗聚集动力学角度定义了可量化的关键动力学参数,如成核速率,生长速率以及核生长起始时,用于评估溶液中单抗聚集速率及制剂条件的优劣(图3)。
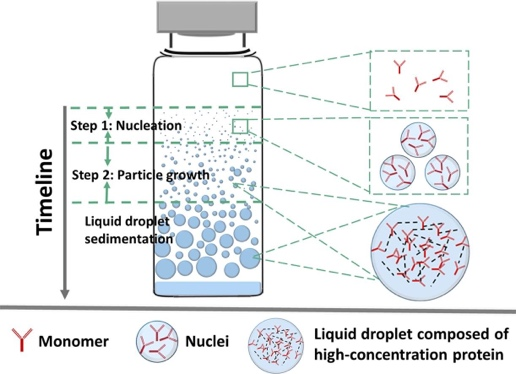

图3. 单抗溶液发生相分离的动力学过程——成核与生长(International Journal of Pharmaceutics, 2020, 588, 119681.)。
我们还对蛋白-蛋白相互作用,蛋白-辅料相互作用的模式进行了深入探讨,发现蛋白溶液制剂中的微小辅料改变,有可能显著改变溶液制剂中蛋白之间的相互作用方式和强度,从而诱导液-液相分离等一系列蛋白溶液制剂稳定性风险(Molecular Pharmaceutics, 2021, 18, 1, 267–274)。这些发现为高浓度蛋白制剂的研发提供了很好的理论基础。
荣誉和奖项
白菜网注册领取体验-杨森研究员(Janssen-Tsinghua Investigator)
“Chemistry Leadership Award”, 百时美-施贵宝制药公司 (Bristol-Myers Squibb Company), 2008
代表性论文
1. Dou L, Liu H., Wang K, Liu J, Liu L, Ye J, Wang R, Deng H, Qian F.*; Albumin binding revitalizes NQO1 bioactivatable drugs as novel therapeutics for pancreatic cancer, Journal of Controlled Release, 2022 Aug 4;349:876-889. doi: 10.1016/j.jconrel.2022.07.033.
2. Kong W, Liu Z, Sun M, Liu H, Kong C, Ma J, Wang R, Qian F.*; Synergistic Autophagy Blockade and VDR Signaling Activation Enhance Stellate Cell Reprogramming in Pancreatic Ductal Adenocarcinoma, Cancer Letters. 2022 Jul 28;539:215718. doi: 10.1016/j.canlet.2022.215718. Epub 2022 May 5.
3. Fang Yuan, Mengnan Sun, Zhengsheng Liu, Huiqin Liu, Weijian Kong, Rui Wang, Qian F*, Macropinocytic dextran facilitates KRAS-targeted delivery while reducing drug-induced tumor immunity depletion in pancreatic cancer. Theranostics. 2022; 12(3): 1061-1073. doi: 10.7150/thno.65299
4. Liu H; Yu S; Qian F*, Opportunities and delusions regarding drug delivery targeting pancreatic cancer-associated fibroblasts, Advanced Drug Delivery Reviews, 2021 May;172:37-51. https://doi.org/10.1016/j.addr.2021.02.012
5. Zhou T,; Qian F.*; Adenosine Triphosphate-Induced Rapid Liquid–Liquid Phase Separation of a Model IgG1 mAb, Mol. Pharmaceutics. 2021 18 (1), 267-274, DOI: 10.1021/acs.molpharmaceut.0c00905
6. Mi W; Chen H; Zhu A, Zhang T, Qian F*, Melting point prediction of organic molecules by deciphering the chemical structure into a natural language, Chemical Communications, 2021, 57, 2633 – 2636
7. Yuan F; Sun M; Liu H; Qian, F.*, Albumin-conjugated drug is irresistible by single gene mutation of endocytic system: verification by genome-wide CRISPR-Cas9 loss-of function screens, Journal of Controlled Release, Vol 323, 10 July 2020, Pages 311-320
8. Hu C.; Liu Z.; Liu C.; Zhang Y.; Fan H.; Qian F.*; Improvement of Antialveolar Echinococcosis Efficacy of Albendazole by a Novel Nanocrystalline Formulation with Enhanced Oral Bioavailability, ACS Infect. Dis. 2020, 6, 5, 802–810
9. Kong C; Li Y; Liu Z; Ye J; Wang Z; Zhang L; Kong W.; Liu H.; Liu C.; Pang H.; Hu Z.; Gao J.; and Qian, F*, Targeting the Oncogene KRAS Mutant Pancreatic Cancer by Synergistic Blocking of Lysosomal Acidification and Rapid Drug Release, ACS Nano, DOI: 10.1021/acsnano.8b08246, March 26, 2019.
10. Liu H; Sun M; Liu Z; Kong C; Kong W; Ye J; Gong J; Huang D; Qian, F.*, KRAS-enhanced macropinocytosis and reduced FcRn-mediated recycling sensitize pancreatic cancer to albumin-conjugated drugs, Journal of Controlled Release, Vol 296, 28 February 2019, Pages 40-53.

