荣誉和奖项
白菜网注册领取体验优秀博士生指导教师(2021, 2018)
白菜网注册领取体验疫情期间线上教学优秀奖(2020)
Thieme Chemistry Journals Award (2019)
中国药学会科学技术奖一等奖(2019,第七完成人)
国家自然科学二等奖(2016,第三完成人)
广东省科学技术奖励一等奖(2015,第四完成人)
Bayer-Tsinghua Investigator Awards (2014),
Janssen-Tsinghua Investigator Awards (2011-2015)
科学贡献
唐叶峰教授长期从事有机合成、药物化学和化员工物学研究。在天然产物合成方面,秉承 “生源合成与理性设计相结合”的研究理念,发展了一系列新颖高效且具有普适性的合成策略,解决了多个家族天然产物(如苍耳烷型倍半萜、百部生物碱、细胞松弛素、扁板海绵聚酮、氢醌/醌-倍半萜等)的多样性合成问题,为系统深入研究其生物功能奠定了物质基础和技术支持。在合成方法学方面,围绕“α-亚胺铑卡宾”和“邻氨基重氮盐”两类合成子开展了一系列具有原创性和系统性的研究工作,实现了多种药物分子优势骨架的高效合成,并将其应用于“基于片段的药物发现(fragment-based drug discovery)”。在药物化学方面,围绕抗病毒和抗衰老药物研发两个主题,发展了一类具有显著抗结核杆菌活性的色氨酰-tRNA合成酶(TrpRS)抑制剂(与GHDDI陈烁课题组合作)和一类具有神经保护作用的烟酰胺单核苷酸腺苷酰转移酶(NMNAT)激动剂(与白菜网注册领取体验王戈林课题组合作),后者已进入临床前研究阶段,具有良好的应用转化前景。在化员工物学方面,以天然产物骨架或全合成中发现的独特化学反应为启发,发展了四类环张力驱动的新型生物正交反应,并将其成功应用于生物大分子标记。
研究领域与方向
本课题组主要研究兴趣为“功能导向的合成化学”,即以具有重要生物功能的活性分子(尤其是天然产物或药物分子)为研究对象,通过发展高效实用、绿色环保的合成方法,实现目标分子的快速、高效和多样性合成,并将其应用于药物化学以及化员工物学等相关研究领域,为创新药物研究提供物质基础和技术支持。课题组重点研究方向包括:1)天然产物全合成:针对具有重要生物活性、新颖化学结构以及奇特生源途径的天然产物进行全合成研究;2) 合成方法学研究:开发各类新方法和新反应(尤其是环张力驱动的扩环反应和三氮唑开环化学研究),快速、高效构建天然产物或药物分子优势骨架;3)药物化学:设计并合成具有抗病毒、抗肿瘤和神经保护活性的小分子化合物,发现具有应用价值的药物及先导化合物;4)化员工物学:发展新型生物正交反应,并将其应用于药物化学以及化员工物学研究。
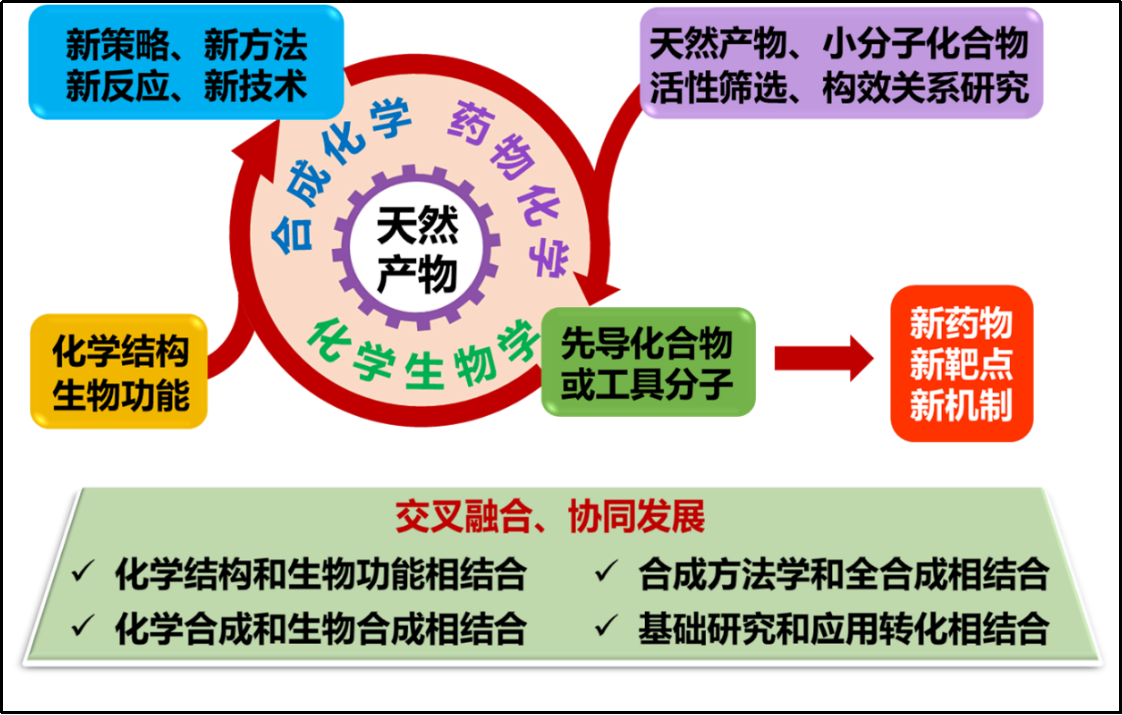
图一:课题组研究方向简介
代表性研究成果
1)基于“生源合成与理性设计相结合”的研究理念,系统解决了以苍耳烷型倍半萜、百部生物碱、细胞松弛素、扁板海绵聚酮及氢醌/醌-倍半萜为代表的多个家族天然产物的高效、多样性合成问题,完成了60多个分子的全合成(其中50%以上为首次全合成),为深入研究其生物功能和药用价值提供了必要的物质基础(图二)。
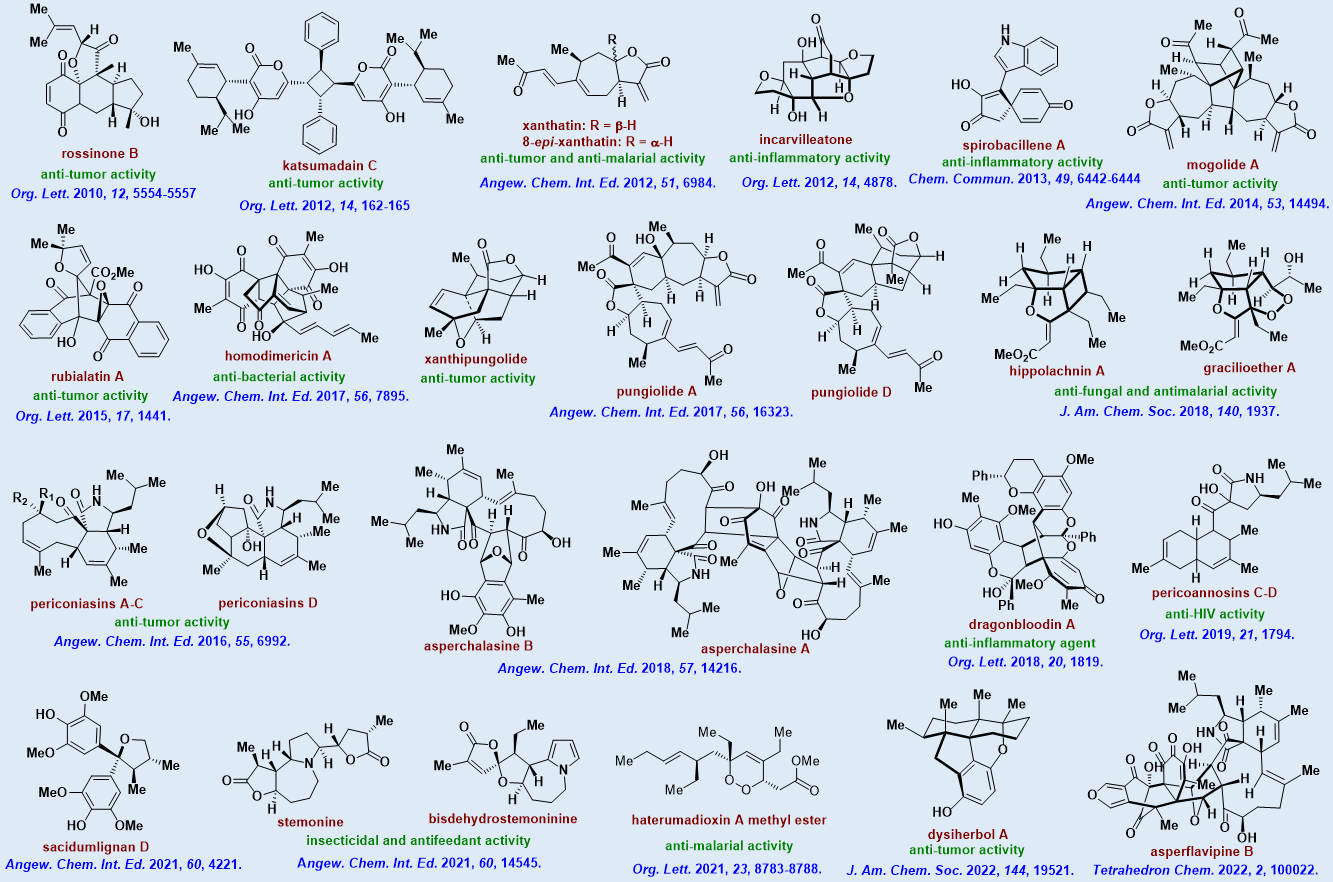
图二:本课题组完成的代表性天然产物全合成
2)围绕“环张力驱动的重排扩环反应”和“三氮唑开环化学”两类特色反应,发展了一系列新颖高效的合成方法学,实现了多种天然产物或药物分子“优势骨架”的高效构建,为天然产物合成和药物化学研究提供了关键的技术支持(图三)。
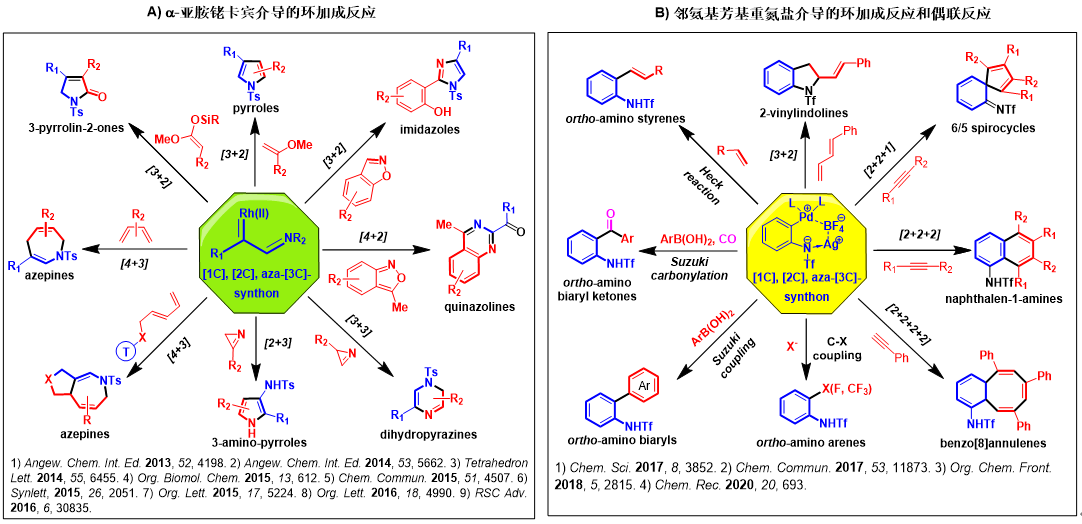
图三:基于三氮唑开环化学的合成方法学研究
3)以天然产物骨架或全合成中发现的独特化学反应为启发,发展了四类环张力驱动的新型生物正交反应,并成功应用于生物大分子的动态修饰(图四)。
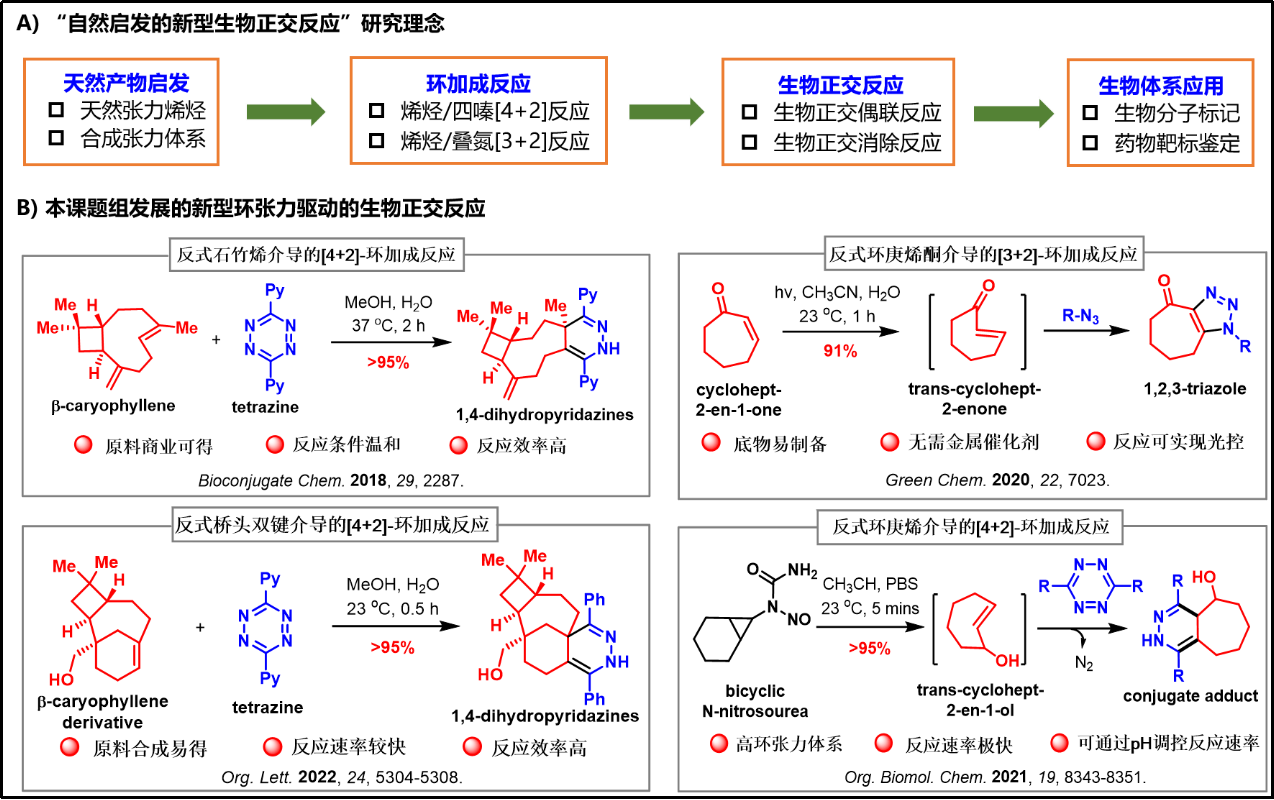
图四:环张力驱动的生物正交反应研究
4)发现了两类具有应用转化潜力的候选药物分子,包括一类具有抗结核杆菌活性的色氨酰-tRNA合成酶(TrpRS)抑制剂(图五)和一类具有神经保护作用的烟酰胺单核苷酸腺苷酰转移酶(NMNAT)激动剂(图六)。
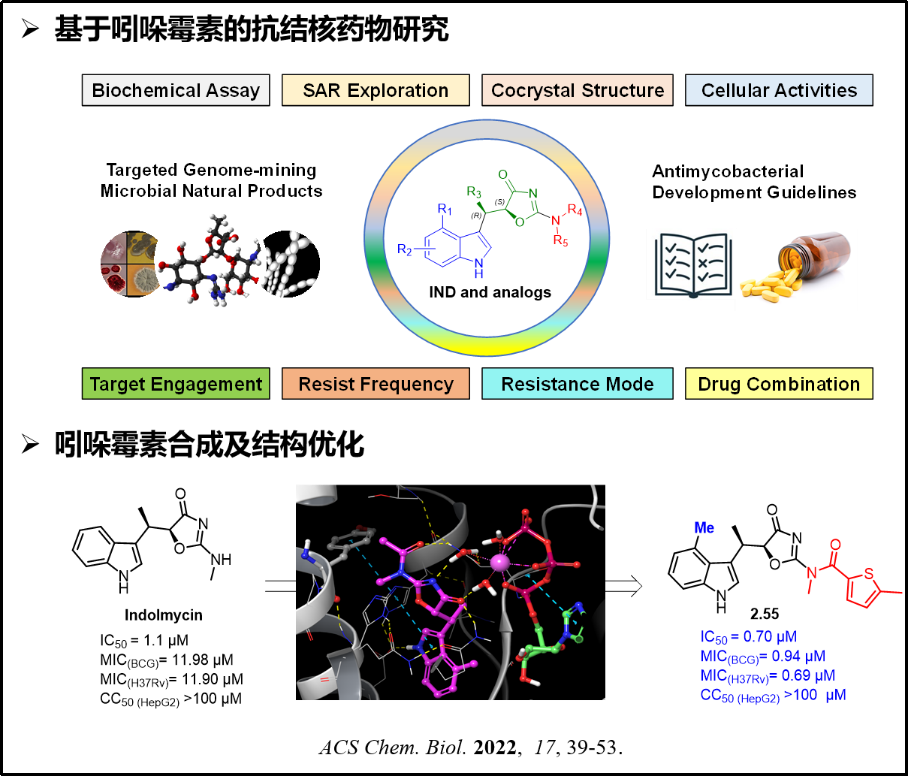
图五:色氨酰-tRNA合成酶抑制剂的设计、合成和活性研究
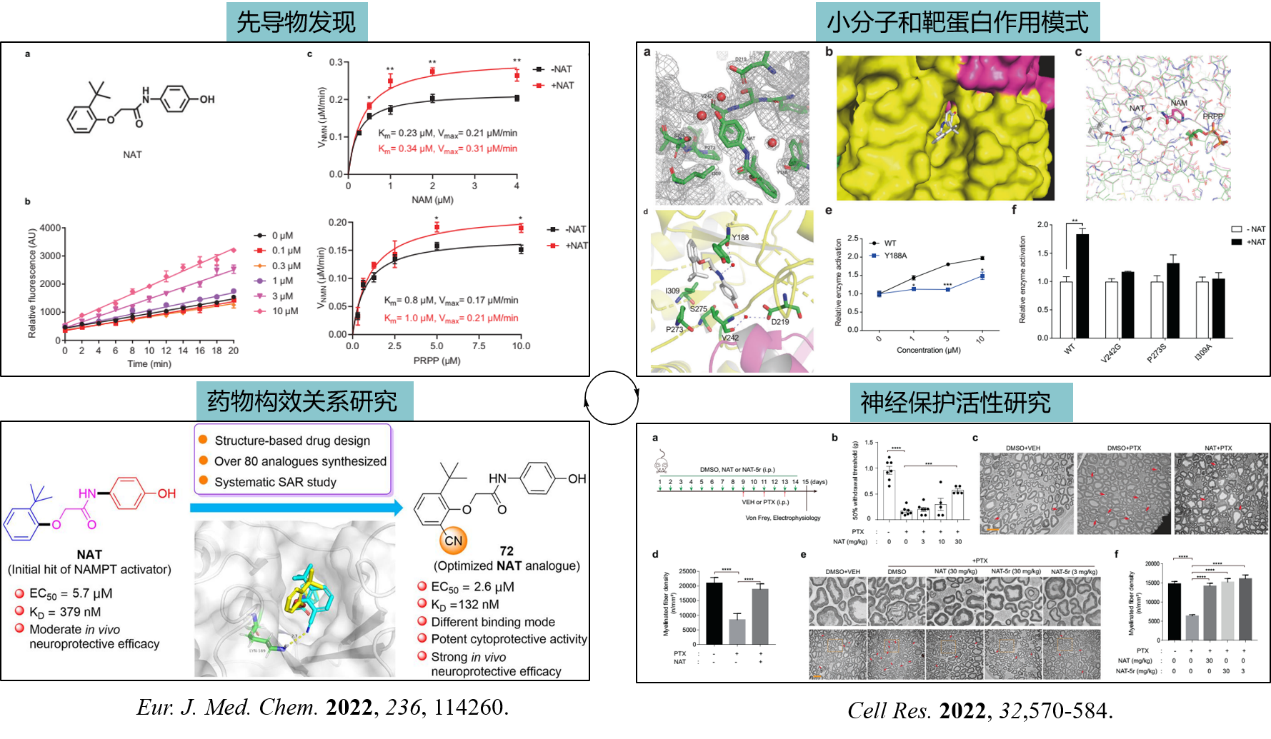
图六:烟酰胺单核苷酸腺苷酰转移酶(NAMPT)激动剂的设计、合成和活性研究
代表性论文
1. Hu, S. K.;
Tang, Y. F. Enantioselective Total Synthesis of Dysiherbols A, C, and D. J. Am. Chem. Soc.
2022, 144, 19521-19531.
2. Yao, H.#; Liu, M. H.#; Wang, L. B.#; Zu, Y. M.#; Wu, C.; Li, C. Y.; Zhang, R. X.; Lu, H. G.; Li, F. F.; Xi, S.; Chen, S. Q.; Gu, X. Y.; Liu, T. Y.; Cai, J.; Wang, S. R.; Yang, M. J.; Hua, L.; Xing, G. G.;
Tang, Y. F.*; Wang, G. L.* Discovery of small-molecule activators of nicotinamide phosphoribosyltransferase (NAMPT) and their preclinical neuroprotective activity. Cell Res.
2022, 32, 570-584.
3. Bao, R. Y.; Zhang, H. Y.;
Tang, Y. F.* Biomimetic Synthesis of Natural Products: A Journey To Learn, To Mimic, and To Be Better. Acc. Chem. Res.
2021, 54, 3720–3733.
4. Guo, Z.; Bao, R. Y.; Li, Y. H.; Li, Y. S.; Zhang, J. Y.;
Tang, Y. F.* Tailored Synthesis of Skeletally Diverse Stemona Alkaloids through Chemoselective Dyotropic Rearrangements of β-Lactones. Angew. Chem. Int. Ed.
2021, 60, 14545–14553.
5. Lei, X. Q.; Li, Y. H.; Lai, Y.; Hu, S. K.; Qi, C.; Wang, G. L.*;
Tang, Y. F.* Strain-Driven Dyotropic Rearrangement: A Unified Ring-Expansion Approach to α-Methylene-γ-butyrolactones. Angew. Chem. Int. Ed.
2021, 60, 4221–4230.
6. Yang, H. Z.; Zeng, T. Y.; Xi, S.; Hu, S. K.; Wu, Y. F.;
Tang, Y. F. Photo-induced, Strain-promoted Cycloadditions of trans-Cycloheptenones and Azides. Green Chemistry,
2020, 22, 7023-7030.
7. Bao, R. Y.; Tian, C.; Zhang, H. Y.; Wang, Z. G.; Dong, Z.; Li, Y. H.; Gao, M. H.; Zhang, H. L.; Liu, G.*;
Tang, Y. F.* Total Syntheses of Asperchalasines A–E. Angew. Chem. Int. Ed.
2018, 57, 14216-14220.
8. Li, Q. G.#; Zhao, K.#; Peuronen, A.; Rissanen, K.; Enders, D.*;
Tang, Y. F.* Enantioselective Total Syntheses of (+)-Hippolachnin A, (+)-Gracilioether A, (-)-Gracilioether E and (-)-Gracilioether F. J. Am. Chem. Soc.
2018, 140, 1937–1944.
9. Feng, J.; Lei, X. Q.; Bao, R. Y.; Li, Y. H.; Xiao, C. Q.; Hu, L. H.;
Tang, Y. F.* Enantioselective and Collective Total Syntheses of Xanthanolides. Angew. Chem. Int. Ed.
2017, 56, 16323–16327.
10. Feng J.#; Lei, X. Q.#; Guo, Z.;
Tang, Y. F.* Total Synthesis of Homodimericin A. Angew. Chem. Int. Ed.
2017, 56, 7895–7899.
11. Wang, Y. F.; Wu, Y. F.; Li, Y. H.;
Tang, Y. F.* Denitrogenative Suzuki and Carbonylative Suzuki Coupling Reactions of Benzotriazoles with Boronic Acids. Chem. Sci.
2017, 8, 3852–3857.
12. Tian, C.; Lei, X. Q.; Wang, Y. H.; Dong, Z.; Liu, G.*;
Tang, Y. F.* Total Syntheses of Periconiasins A-E. Angew. Chem. Int. Ed.
2016, 55, 6992–6996.
13. Shang, H.#; Liu, J. H.#; Bao, R. Y.; Cao, Y. Zhao, K.; Xiao, C. Q.; Zhou, B.; Hu, L. H.*;
Tang, Y. F.* Biomimetic Synthesis: Discovery of Xanthanolide Dimers. Angew. Chem. Int. Ed.
2014, 53, 14494–14498.
14. Shang, H.#; Wang, Y. H.#; Tian, Y. Feng, J.;
Tang, Y. F.* The Divergent Synthesis of Nitrogen Heterocycles by Rhodium(II)-Catalyzed Cycloadditions of 1-Sulfonyl 1,2,3-Triazoles with 1,3-Dienes. Angew. Chem. Int. Ed.
2014, 53, 5662–5666.
15. Fu, J. K.; Shang, H.; Wang, Z. F.; Chang, L.; Shao, W. B.; Yang, Z.*;
Tang Y. F.* Gold-Catalyzed Rearrangement of Allylic Oxonium Ylides: Efficient Synthesis of Highly Functionalized Dihydrofuran-3-ones. Angew. Chem. Int. Ed.
2013, 52, 4198–4202.
16. Ren, W. W.; Bian, Y. C.; Zhang, Z. Y.; Shang, H.; Zhang, P. T.; Chen, Y. J.; Yang, Z.*; Luo T. P.*;
Tang Y. F.* Enantioselective and Collective Syntheses of Xanthanolides by Controllable Dyotropic Rearrangement of cis--Lactones. Angew. Chem. Int. Ed.
2012, 51, 6984–6988.
17. Xiao, Q.#; Ren W. W.#; Chen, Z. X.; Sun, T. W.; Li, Y.; Ye, Q. D.; Gong, J. X.; Meng, F. K.; You, L.; Liu, Y. F.; Zhao, M. Z.; Xu, L. M.; Shan, Z. H.; Shi, Y.;
Tang, Y. F.*; Chen, J. H.*; Yang Z.* Diastereoselective Total Synthesis of (+)-Schindilactone A. Angew. Chem. Int. Ed.
2011, 50, 7373–7377.
18. Nicolaou, K. C.*; Wang, J. H.;
Tang, Y. F.; Botta, L. Total Synthesis of Sporolide B and 9-epi-Sporolide B. J. Am. Chem. Soc.
2010, 132, 11350–11363.
19. Nicolaou, K. C.*;
Tang, Y. F.; Wang, J. H. Total Synthesis of Sporolide B. Angew. Chem. Int. Ed.
2009, 48, 3501–3505.
20. Nicolaou, K. C.*;
Tang, Y. F.; Wang, J. H. Total Synthesis and Antibacterial Properties of Carbaplatensimycin. J. Am. Chem. Soc.
2007, 129, 14850-14851.

